Изменение свойств химических элементов и их соединений
| Рассматриваемое свойство | Изменение свойств в периоде | Изменение свойств в главных подгруппах |
| Заряд ядра | Увеличивается | Увеличивается |
| Число энергетических уровней | Постоянно (равно номеру периода) | Возрастает |
| Число валентных электронов | Возрастает | Постоянно (равно номеру группы) |
| Радиус атома | Немного убывает (сжатие атома) | Резко увеличивается |
| Притяжение внешних электронов к ядру | Усиливается | Ослабевает |
| Восстановительные свойства | Ослабевают | Усиливаются |
| Высшая степень окисления | Возрастает | Постоянна (равна номеру группы) |
| Металлические свойства простых веществ | Ослабевают | Усиливаются |
| Основные свойства оксидов и гидроксидов | Ослабевают | Усиливаются |
| Кислотные свойства оксидов и гидроксидов | Усиливаются | Ослабевают |
| Кислотный характер водных растворов летучих водородных соединений | Усиливается | Усиливается |
Задания для самостоятельного выполнения
1. Расположите следующие элементы в порядке возрастания восстановительных свойств: фосфор, магний, хлор.
2. Расположите следующие вещества в порядке ослабления неметаллических свойств: сурьма, висмут, кремний, фосфор.
3. Укажите, какая из двух кислот более сильная (ответ поясните):
а) Н2Se или H2Te б) H2CrO4 или HMnO4
4. Для элементов с атомными номерами 33, 37, 17, 31, 41 составьте формулы высшего оксида, высшего гидроксида, укажите их характер. Назовите высшую и низшую из возможных степеней окисления.
5. Составьте формулы соединений с водородом элементов, если известны формулы их высших оксидов:
а) Э2О б) Э2О5 в) ЭО г) Э2О3 д) ЭО3
6. Дайте полную характеристику элементов под номерами 42 и 35.
СТРОЕНИЕ АТОМА.
РАСПОЛОЖЕНИЕ ЭЛЕКТРОНОВ ПО ЭНЕРГЕТИЧЕСКИМ УРОВНЯМ
Атом химического элемента– это электронейтральная система, состоящая из положительно заряженного ядра, в котором сосредоточена практически вся масса атома, и расположенных около ядра электронов.
Атомный (или порядковый) номер элемента указывает на заряд ядра атома. В этом физический смысл атомного номера элемента.
В атоме число протонов, определяющих величину заряда ядра атома, и число электронов одинаково. Это определяет электронейтральность атома.
Массовое число -суммарное число протонов и нейтронов в ядре.
А = Z + N
Число нейтронов N можно рассчитать как разность между массовым числом А и числом протонов Z.
Химический элемент – это вид атомов с одинаковым зарядом ядра. Заряд ядра является основной характеристикой атома химического элемента.
Изотопы– атомы одного химического элемента (имеющие одинаковый заряд ядра атома), но различающиеся массовыми числами.
Относительная атомная масса представляет собой среднее арифметическое массовых чисел всех изотопов данного химического элемента.
Задание 1. Определите число протонов, нейтронов и электронов в атоме изотопа фосфора 31Р.
В периодической системе химических элементов Д.И. Менделеева (ПС) фосфор имеет атомный номер 15. Следовательно. Заряд его ядра +15. Значит, в ядре расположены 15 протонов, общее число электронов а атоме – 15. Число нейтронов N= 31-15 = 16.
По современным представлениям электрон в атоме имеет двойственную природу (частица и волна одновременно). Электрон не имеет определенной координаты в пространстве, не перемещается по траектории. Говорят о его вероятностном нахождении в каждой точке пространства.
Электронное облако (орбиталь) –область пространства вокруг ядра, в которой наиболее вероятно нахождение электрона. Состояние электронов в атоме описывают набором квантовых чисел. Для каждого электрона данного атома набор из 4 квантовых чисел индивидуален.
Квантовые числа.
1. Главное квантовое число(n) характеризует энергию электрона и его удаленность от ядра. Электроны с равным запасом энергии и одинаково удаленные от ядра объединяют в один энергетический уровень.
n = 1, 2, 3 … 7 Чем меньше значение n, тем ближе расположен электрон к ядру, тем сильнее он притягивается к ядру, запас энергии таких электронов минимален. Численное значение n равно номеру энергетического уровня, на котором можно расположить электрон.
Зная n, можно рассчитать максимальное число электронов на каждом энергетическом уровне, т.е. сколько электронов имеют примерно одинаковый запас энергии.
N = 2 · n2, где N – максимальное число электронов
При n = 1 N= 2
n= 2 N= 8
n= 3 N=18 и т. д.
2. Орбитальное (побочное) квантовое число (l)- описывает форму электронной орбитали. Если орбиталь имеет сферическую форму, ее называют s-орбиталью, если форма гантелеобразная – р-орбиталь. Еще более сложные формы получили название d-орбитали и f-орбитали.
О s-орбиталь ∞ -р-орбиталь
Электроны с одинаковым запасом энергии могут занимать различную по форме область пространства, в этом случае говорят о подуровне (s, p, d, f- подуровни).
3. Магнитное квантовое число(ml) – характеризует ориентацию орбитали в пространстве:
-s-орбиталь всегда одна, так как вращение ее в трехмерном пространстве к изменению расположения не приводит.
-р-обитали могут быть ориентированы по осям x, y, z . Следовательно, они могут располагаться в одном из трех взаимно перпендикулярном положении.
-d-орбиталей насчитывают 5 штук (по разному ориентированных в пространстве), f-орбиталей должно быть 7 и т.д.
На схеме будем показывать каждую из возможных орбиталей прямоугольником □ или черточкой —.
s —
p — — —
d — — — — —
4. Спиновое квантовое число(ms) – описывает вращение электронов вокруг своей оси (по или против часовой стрелки). На схеме различное вращение электронов показывают стрелками ↑ или ↓.
Принципы заполнения электронных орбиталей:
1. На одной орбитали не может находиться более двух электронов.
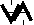
2. При заполнении орбиталей одного подуровня наиболее устойчиво состояние, при котором число неспаренных электронов наибольшее.
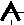
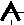
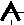 (направление вращения электронов одинаково).
(направление вращения электронов одинаково).
3.Порядок заполнения подуровней определяется принципом
наименьшей энергии:
