Энергетика химических процессов
Введение
Науку о взаимных превращениях различных видов энергии называют термодинамикой.
При химических реакциях происходят глубокие качественные и количественные изменения в системах: рвутся связи в исходных веществах, возникают новые связи в конечных продуктах. Эти изменения сопровождаются поглощением или выделением энергии. В большинстве случаев этой энергией является теплота.
Раздел термодинамики, изучающий тепловые эффекты химических реакций, называют термохимией. Реакции, которые сопровождаются выделением теплоты, называют экзотермическими, а поглощением теплоты - эндотермическими.
С помощью энергетики химических процессов решают многие научные и технологические задачи, например, определения:
- условий протекания реакций;
- энергий кристаллических решёток;
- теплот и температур сгорания;
- теплотворной способности веществ;
- термической устойчивости веществ
- и др.
При любом процессе соблюдается закон сохранения энергии, как проявление более общего закона природы – закона сохранения материи. Согласно первому закону химической термодинамики теплота Q, поглощённая системой, идет на изменения ее внутренней энергии ΔU и на совершение работы A:
Q = ΔU + A
Внутренняя энергия системы U – это общий ее запас, включающий энергию поступательного и вращательного движения молекул, энергию внутримолекулярных колебанийатомов и атомных групп, энергию движения электронов, внутриядерную энергию и т.д. Внутренняя энергия – полная энергия системы без потенциальной энергии, обусловленной положением системы в пространстве, и без кинетической энергии системы как целого. Абсолютное значение внутренней энергии U веществ не известно, так как нельзя привести систему в состояние, лишенное энергии. Внутренняя энергия, как и любой вид энергии, является функцией состояния, то есть ее изменение определяется начальным и конечным состояниями системы:
ΔU = U2 – U1
А – работа против внешнего давления, в первом приближении А = PΔV, где ΔV – изменение объема системы: ΔV = V2 – V1
Большинство химических реакций протекают в изобарно- изотермических условиях: Р = Const и T = Const, поэтому:
QP,T = ΔU + PΔV; QP,T = (U2 – U1) + p (V2 – V1),
QP,T = (U2 + pV2) – (U1 + pV1), где U + pV обозначим через Н
Величину Н называют энтальпией. Таким образом, теплота QP,T при Р = const и
Т = const приобретает свойство функции состояния: ее изменение не зависит от пути, по которому протекает процесс. Отсюда QP,T реакции в изобарно-изотермическом процессеравна изменению энтальпии системы ΔН (если единственным видом работы является работа расширения):
Qp,Т = ΔН
Энтальпия, как и внутренняя энергия, является функцией состояния: ее изменение ΔН определяется только начальным и конечным состояниями системы и не зависит от пути перехода.
Теплота химического процесса в изобарно-изотермических условиях называется тепловым эффектам химической реакции.
Термохимические расчеты основаны на законе Г.И. Гесса (1840 г.): тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
Часто в термохимических расчетах применяют следствие закона Г.И. Гесса: тепловой эффект реакции (ΔНх.р.) равен сумме теплот образования ΔНобр. продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции:
ΔНх.р. = Σ ΔНпрод. - Σ ΔНисх в-в.
Примеры решения задач
Пример 1.Реакция горения жидкого этилового спирта выражается термохимическим уравнением:
C2H5OH(ж) + O2(г) = 2CO2(г) + 3H2O(ж); ΔH = ?
Вычислите тепловой эффект реакции, если известно, что мольная теплота парообразования C2H5OH(ж) равна +42,36 кДж, а теплоты образования C2H5OH(г), CO2(г) и H2O(ж) соответственно равны, кДж/моль: -235,31; -393,51 и -285,84.
Решение.Для определения ΔH реакции необходимо знать теплоту образования C2H5OH(ж), находим ее из данных:
C2H5OH(ж) D C2H5OH(г); ΔH = +42,36 кДж
Из фазового перехода определим теплоту образования жидкого C2H5OH (ж):
+42,36 = -235,31 – ΔH C2H5OH(ж);
ΔH C2H5OH(ж) = -235,31 – 42,36 = -277,67 кДж
Вычислим ΔH реакции, применяя следствие из закона Г.И. Гесса:
ΔHoх.р = 2 ΔHoCO2(г) + 3 ΔH oH2O(ж) – ΔHo C2H5OH(ж)
ΔHoх.р. = 2(-393,51) + 3(-285,84) -( -277,67) = -1366,87 кДж.
Вывод: реакция горения жидкого этилового спирта протекает с выделением большого количества тепла -1366,87 кДж.
Контрольные задания
Для решения задач нужно использовать справочный материал по дисциплинам «Химия» и «Коррозия металлов» для студентов первого курса всех специальностей и форм обучения, № 1639, авторов Васильченко Л.М., Сеницкой Г.Б., Халиковой А.В. и Сотовой Н.В.
81. Определите тепловой эффект реакции разложения 1 моля бертолетовой соли КСlО3(к) , протекающей по уравнению:
2КСlО3(к) = 2КСl(к) + 3О2(г).
Напишите термохимическое уравнение. Определите, сколько тепла выделится при разложении 100 г бертолетовой соли. Какая из солей KCl или KClO3 более термически стойкая?
Ответы: - 44,7 кДж, - 36,5 кДж
82. Вычислите тепловой эффект реакции спиртового брожения глюкозы (под действием ферментов), если известны теплоты образования C6H12O6 (к), C2H5OH (ж) соответственно, кДж /моль: - 1273,0; -277,6:
С6Н12О6(к) = 2 С2Н5ОН(ж) + 2СО2(г)
Напишите термохимическое уравнение. Сколько выделится тепла при брожении 1кг глюкозы?
Ответы: -69,22 кДж; -384,55 кДж.
83. Реакция горения аммиака выражается уравнением:
4 NН3 (г) + 5О2(г) = 4 NО (г) + 6Н2О(г).
Вычислите тепловой эффект реакции в пересчете на 1 моль NН3 (г). Напишите термохимическое уравнение горения аммиака.
Ответ: -226,2 кДж
84. Рассчитайте энтальпию образования жидкого сероуглерода CS2 по следующим данным:
Sмонокл. + О2(г) = SО2(г); DН = -296,9 кДж;
СS2(ж) + 3О2(г) = СО2(г) + 2SО2(г); DН = -1076,43 кДж;
С(граф.) + О2(г) = СО2(г); DН = -393,5 кДж.
Ответ: +89,12 кДж · моль-1.
85. Определите тепловой эффект химической реакции
Al2O3 (к) + SO3 (г) = Al2 (SO4)3 (к) ,
зная при стандартных условиях теплоты образования Al2O3 (к), SO3 (г) и Al2(SO4)3 (к) соответственно, кДж·моль-1: -1676,0; -395,8 и -3441,2. Сколько тепла выделится, если в реакции участвует 0,25 моль Al2O3 (к)?
Ответы: -1370 кДж; -342,5 кДж
86.Вычислитетепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
FeO (к) + CO (г) = Fe (к) + CО2 (г); DH = -18,20 кДж;
СO (г) + 1/2O2 (г) = СO2 (г) DН = -283,0 кДж;
H2 (г) + ½ O2 (г) = H2O (г) DН = -241,83 кДж.
Ответ: + 23 кДж
87. Растворение моля безводной соды Na2CO3 в достаточно большом количестве воды сопровождается выделением 25,10 кДж теплоты, тогда как при растворении кристаллогидрата Na2CO3×10Н2О поглощается 66,94 кДж теплоты. Составьте термохимические уравнения процессов гидратации и растворения гидратированной соли. Вычислите теплоту гидратации Na2CO3.
Ответ: -91,04 кДж.
88. Тепловой эффект реакции восстановления оксида вольфрама WO3(к) водородом, приводящий к образованию вольфрама и паров воды, равен +117,2 кДж. Вычислите теплоту образования оксида вольфрама. Сколько нужно затратить тепла для получения 500 г вольфрама?
Ответы: -842,7 кДж · моль-1; + 318,82 кДж.
89. Реакция горения аммиака выражается термохимическим уравнением:
4NH3(г) + 3О2(г) = 2N2(г) + 6H2О(ж); DН = -1530,0 кДж.
Вычислите теплоту образования аммиака NH3(г).Сколько тепла выделяется при сгорании 10 молей NH3(г)?
Ответы: -46,2 кДж · моль-1 ; – 3825 кДж.
90.При получении одного грамм-эквивалента гидроксида кальция из CaO(к) и Н2О(ж) выделяется 32,75 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования оксида кальция.
Ответ: - 635, 5 кДж.
91. Вычислите теплоту образования карбида кальция СаС2, исходя из теплового эффекта реакции:
СаО(т) + 3С(т) = СаС2(т) + СО(г) +462,2кДж
и стандартных энтальпий образования СаО и СО. Сколько нужно затратить тепла для получения 100 кг СаС2(т)?
Ответы: – 62,8 кДж · моль-1; +7,22 · 105кДж.
92. Вычислите тепловой эффект реакции горения толуола С7Н8(ж):
С7Н8(ж) + 9О2(г) = 7 СО2(г) + 4Н2О(г)
Напишите термохимическое уравнение. Сколько тепла выделится при сгорании 200 г толуола?
Ответ: -3771,9 кДж; - 8199,8 кДж.
93. Используя энтальпии образования веществ, определите DН0 химической реакции:
2Mg(к) + СО2(г) = 2MgО(к) + Сграфит.
Сколько образуется графита, если в реакцию вступит 100 г Mg и сколько выделится тепла при этом?
Ответы: – 810,1 кДж; 25 г; - 1687,5 кДж.
94. Реакция окисления этилового спирта выражается уравнением:
С2Н5ОН(ж) + 3,0 О2(г) = 2СО2(г) + 3Н2О(ж) .
Определить теплоту образования С2Н5ОН(ж) , зная DН х.р. = - 1366,87 кДж. Напишите термохимическое уравнение. Определите мольную теплоту парообразования С2Н5ОН(ж) ® С2Н5ОН(г), если известна теплота образования С2Н5ОН(г), равная –235,31 кДж · моль-1.
Ответы: - 277,67 кДж · моль-1 ; +42,36 кДж · моль-1
95. Рассчитайте, сколько тепла выделится при гашении 50 кг 80%-ной негашеной извести, если теплота гашения на 1 моль СаО составляет - 65 кДж/моль. Определите теплоту образования гашеной извести.
Ответы: -4,64 · 104 кДж; -986,6 кДж · моль-1 .
96. Реакция горения бензола выражается термохимическим уравнением:
С6Н6(ж) + 7½ О2(г) = 6СО2(г) + 3Н2О(г) – 3135,6 кДж.
Вычислите теплоту образования жидкого бензола. Определите теплотворную способность жидкого бензола при условии, что стандартные условия совпадают с нормальными.
Ответы: 49,1 кДж · моль-1; -1,4 ·10 5 кДж.
97. Определите тепловой эффект сгорания природного газа, протекающего по уравнению:
СН4(г) + 2О2(г) = СО2(г) + 2Н2О(г),
Сколько тепла выделится при сгорании 1 м3 газа? Расчет проведите с допущением, что стандартные условия течения реакции совпадают с нормальными условиями.
Ответы: - 802,3 кДж; - 35817 кДж.
98. Определите тепловой эффект сгорания жидкого сероуглерода CS2(ж) до образования газообразных СО2 и SO2. Сколько молей CS2 вступят в реакцию, если выделится 700 кДж тепла?
Ответы: -1076,43 кДж; 0,6 моль.
99. Вычислите тепловой эффект реакции восстановления Fe2O3 металлическим алюминием. Напишите термохимическое уравнение. Сколько выделяется тепла, если в реакцию вступают 8 молей Fe2O3 и сколько молей железа образуется при этом?
Ответы: -853,84 кДж;- 6830,7 кДж; 16 моль.
100. На восстановление 14 г диоксида кремния SiO2 (к) углеродом, в результате которого образуются кремний и оксид углерода СО(г), требуется 148,7 кДж теплоты. Рассчитайте тепловой эффект реакции и напишите термохимическое уравнение. Вычислите теплоту образования SiO2.
Ответы: +638,3кДж; -859,3 кДж · моль-1.
ХИМИЧЕСКОЕ СРОДСТВО
Примеры решения типовых задач
Пример 1.Определите направление протекания при стандартных условиях реакции: Fe2O3(к) + 3H2(г) = 2Fe(т) + 3H2O(г)
Решение.Чтобы определить направление протекания реакции, нужно вычислить изменение стандартной энергии Гиббса
Согласно следствию из закона Гесса: ΔG = ΣΔG0кон – ΣΔG0нач
Выпишем из табл.1 значения энергий Гиббса образования для всех участников реакции
| Fe2O3(к) | H2(г) | Fe(т) | H2O(г) | |
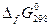 , кДж/моль , кДж/моль | –740,3 | –228,6 |
Отсюда ΔG° = { 2∙0 + 3 ∙ ( -228,6) } – { -740,3 + 3 ∙ 0 } = 54,5 кДж/моль.
Т.к. ΔG > 0, в стандартных условиях эта реакция идет в обратном направлении.
Пример 2 .Определите знаки DН0, DS0 и DG0 для реакции
АВ(к)+ В2(г) = АВ3(к),
протекающей при 298 К в прямом направлении. Будет ли DG0 возрастать или убывать с ростом температуры?
Решение.Поскольку известно, что реакция протекает в прямом направлении, следовательно, ΔG < 0.
В левой части уравнения 1 молекула газа (В2), а в правой части уравнения газа нет, следовательно, при протекании данной реакции энтропия системы уменьшается, т.е. ΔS <0.
Поскольку DН0, DS0 и DG0 реакции связаны друг с другом уравнением:
ΔG0 = ΔH0– T·ΔS0,
то знак изменения энтальпии системы может быть только отрицательным: DН<0.
Т.к. энтропийная составляющая данной реакции положительна, то с ростом температуры DG будет возрастать, и выше некоторой температуры реакция будет протекать в обратном направлении.
Пример 3 . При какой температуре начнетсяреакция:
С6Н6 (ж) + НNO3 (ж) = С6Н5NO2(ж) + Н2О (ж)?
При каких температурах реакция будет протекать в прямом, а при каких – в обратном направлении?
Решение. Температура начала реакции рассчитывается по формуле:
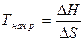
DН0 и DS0 рассчитывают по следствию из закона Гесса:
ΔH = ΣΔf H0кон – ΣΔf H0нач
ΔS = ΣS0кон – ΣS0нач ,
используя значения энтальпий образования и абсолютных энтропий участников реакции из таблицы 1:
| С6Н6 (ж) | НNO3 (ж) | С6Н5NO2(ж) | Н2О (ж) | |
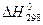 , кДж/моль , кДж/моль | 49,03 | -173,00 | 15,90 | 285,83 |
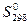 , Дж/моль К , Дж/моль К | 173,26 | 156,16 | 224,26 | 69,95 |
ΔH = (15,90-285,83) – (49,03-173,00) = -145,70 кДж
ΔS = (224,26+69,95) – (173,26+156,16) = -35,21 Дж/ К = -0,035 кДж/ К.
Данная реакция начнется при температуре
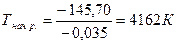 .
.
Поскольку в данной реакции энтальпийная составляющая отрицательная (DН<0), а энтропийная – положительная( -Т ΔS >0), то в соответствии с уравнением:
ΔG0 = ΔH0– T·ΔS0,
при Т > 4162 К реакция будет идти в обратном направлении (ΔG > 0), а при Т < 4162 К - в прямом направлении (ΔG < 0).
Контрольные задания
101. Прямая или обратная реакция будет протекать в системе:
MnO2(к) + 4HCl(г) ↔ MnCl2(к) + Cl2(г)
Ответ мотивируйте, вычислив DG0 прямой реакции по стандартным энтальпиям образования и абсолютным энтропиям химических веществ. Изменится ли направление процесса при повышении температуры до 1000 С?
Ответ: - 52,07 кДж; - 46,07 кДж.
102.При какой температуре наступит равновесие системы:
2 NO (г) + Cl2 (г) ↔ 2 NOCl (г)?
При каких температурах реакция будет протекать в прямом, а при каких – в обратном направлении?
Ответ: 623,5 К.
103. Не прибегая к вычислениям, определите, какие знаки (>0, <0, @0) имеют DG, DH и DS для протекающей в обратном направлении реакции:
2 Н2O (г) + 2 I2(г) ↔ 4 HI (г) + O2 (г).
Как повлияет повышение температуры на направленность химической реакции?
104. При какой температуре наступит равновесие системы:
2 НCl (г) + I2(к) ↔ 2 HI (г) + Cl2 (г)?
При каких температурах более сильным восстановителем будет являться иод, а при каких – хлор?
Ответ: 1557 К.
105. С чем будет более интенсивно взаимодействовать газообразный хлористый водород (в расчете на 1 моль): с цинком или с алюминием? Ответ дайте, рассчитав DG обеих реакций. Продуктами реакций являются твердая соль и газообразный водород.
Ответ: - 89,91 и – 114,74 кДж/моль HCl.
106. Рассчитав на основании табличных данных DG и DS, определите тепловой эффект реакции: AsF3 (г) + F2 (г) ↔ AsF5 (г). Экзотермической или эндотермической является данная реакция?
Ответ: - 316,15 кДж.
107. Вычислите изменение энергии Гиббса при 250С для реакции
СН4 (г) +2Н2S(г) → CS2(ж)+ 4H2(г)
по стандартным значениям энтальпий образования и абсолютных энтропий химических веществ. Можно ли назвать этот процесс самопроизвольным? Изменится ли направление процесса при повышении температуры до 1500С? Укажите роль энтальпийного и энтропийного факторов.
Ответ: 183,06 и 171,74 кДж.
108. Чем можно объяснить, что при стандартных условиях, невозможна экзотермическая реакция: СО2 (г)+Н2 (г) ↔ СО (г)+Н2О (ж)? Рассчитайте DG данной реакции. При каких температурах данная реакция становится самопроизвольной?
Ответ: 19,91 кДж.
109. Не производя вычислений, установить знак DS следующих процессов:
а) СаО(к) + СО2(г) = СаСО3(к);
б) испарение воды;
в) NН3(г) + НCl(г) = NН4Cl(к);
г) СН3СООН (р) ® СН3СОО-(р) + Н+(р).
Ответ поясните.
110. Рассчитайте DG0 реакции:
4NH3(г) +5O2(г) = 4NО(г) + 6Н2О(ж)
и сделайте вывод о возможности самопроизвольного протекания данного процесса. Не производя вычислений укажите, каково будет изменение энтропии.
Ответ: -957,8 кДж.
111. Прямая или обратная реакция будет протекать в системе:
8NH3(г) + 3Br2(ж)→6NH4Br(к) + N2(г)?
Ответ мотивируйте, вычислив DG0 прямой реакции по стандартным энтальпиям образования и абсолютным энтропиям химических веществ. Изменится ли направление процесса при повышении температуры до 8000 С?
Ответ: - 1584,87 кДж; - 2452,95 кДж.
112.При какой температуре наступит равновесие системы:
РСl5 (г) ↔РСl3 (г) + С12 (г)?
При каких температурах реакция будет протекать в прямом, а при каких – в обратном направлении?
Ответ: 447,6 К.
113. Не прибегая к вычислениям, определите, какие знаки (>0, <0, @0) имеют DG, DH и DS для протекающей в прямом направлении реакции:
СО2 (г) + 4 Н2(г) ↔ СH4 (г) + 2 Н2О (ж).
Как повлияет повышение температуры на направленность химической реакции?
114. Какие из карбонатов: ВеСО3, МgСО3 или СаСО3 можно получить по реакции взаимодействия соответствующих оксидов с СО2? Какая реакция идет более энергично? Ответ дайте, вычислив DG реакций.
Ответ: 31,24; - 65,32; - 130,17 кДж.
115. При какой температуре наступит равновесие системы:
4 НBr (г) + O2(г) ↔ 2 H2O (г) + 2 Br2 (г)?
При каких температурах более сильным окислителем будет являться кислород, а при каких – бром?
Ответ: 2155 К.
116. Пользуясь справочными данными, определите, возможно ли получение ванадия при температуре 298 К по схеме:
2V2O5(к) +5C(к) = 2V(к) + 5CО2(г).
Как будет влиять повышение температуры до 3000оС на направление реакции?
Ответ: 1384,4 кДж; 11136,45 кДж.
117. На основании расчета значений DG0 реакций:
2 NO (г) + Br2 (г) ↔ 2 NOBr (г)
и 2 NO (г) + F2 (г) ↔ 2 NOF (г)
определите, бром или фтор является более сильным окислителем при стандартных условиях и при температуре 850оС.
Ответ: - 11,33 кДж; 87,42 кДж; - 291,72 кДж;
- 231,41 кДж.
118. С чем будет более интенсивно взаимодействовать газообразный иодистый водород (в расчете на 1 моль): с калием или с кальцием? Ответ дайте, рассчитав DG0 обеих реакций. Продуктами реакций являются твердая соль и газообразный водород.
Ответ: - 325,88 и -266,28 кДж/моль.
119. На основании расчета значений DG0 реакций:
N2 (г) + О2 (г) ↔ 2 NO (г)
и N2 (г) + 2 О2 (г) ↔ 2 NO2 (г)
определите, какой из оксидов будет преимущественно образовываться при стандартных условиях и при 600оС?
Ответ: 175,64 кДж; 166,27 кДж; 104,59 кДж; 179,05 кДж.
120. Рассчитайте DG0 реакции:
2 Сu(NO3)2 (к) = 2 CuО (к) +4 NO2(г)+ O2(г)
и сделайте вывод о возможности самопроизвольного протекания данного процесса при стандартных условиях. Не производя вычислений, укажите, каково будет изменение энтропии, а также экзо- или эндотермической является данная реакция.
Ответ: 281,5 кДж.
