Соединения ртути(II). Оксид ртути(II)
Оксид ртути(II) — бинарное соединение ртути и кислорода с формулой HgO. Это твёрдое непрочное при нормальных условиях вещество красного или оранжевого цвета является основным и важнейшим оксидом ртути и практически не встречается в природе.
Красный оксид ртути получают нагреванием ртути до 350 °C или пиролизом нитрата ртути.
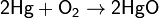
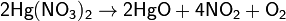
Жёлтый оксид получают осаждением солей ртути(II) щелочами, например:
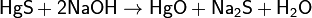
Разница в цвете объясняется размером частиц, обе формы имеют одинаковую структуру — цепь линейных звеньев состава O-Hg-O соединённых под углом 108°. Размеры частиц жёлтого оксида ртути составляют до 4 мкм, красной — более 8 мкм.
Жёлтый HgO является более химически активным, разлагается при температуре 332oC, при нагревании краснеет. Красный HgO распадается при 500, а при нагревании обратимо меняет свой цвет на чёрный.
Оксид ртути(II) в воде малорастворим, его насыщенный водный раствор имеет концентрацию 2,6·10-4 моль/л для жёлтой формы и 2,4·10-4 моль/л для красной. Проявляет слабые основные свойства.
Растворяется в концентрированных растворах щелочей, при этом образуются гидроксокомплексы. Жёлтый HgO взаимодействует с NH3 с образованием основания Миллона:

Это вещество реагирует с кислотами, образуя соответствующие соли [Hg2N]•H2O (X = NO3-, ClO3-, Cl3-, Br3-, I3-).
Применяется для получения ртути, а также в некоторых видах гальванических элементов. Обладает сильным токсическим действием.
Соли ртути(II). Их гидролиз.
HgCl2 – сулема, устойчива на воздухе, токсична, растворяется в воде, спирте, эфире, сероуглероде. Сулема – сильнейший яд! Обычно сулему получают, нагревая сульфат ртути (II) с хлоридом натрия:
HgSO4 + 2NaCl = Na2SO4 + HgCl2
При нагревании сулема разлагается:
HgCl2 = Hg + Cl2
В водных растворах сулема подвергается гидролизу:
HgCl2 + HOH = Hg(OH)Cl + HCl
Hg2+ + HOH = HgOH+ + H+, pH < 7.
В растворах молекулы хлорида ртути ассоциированы и склонны к образованию аутокомплексов:
2HgCl2 = Hg[HgCl4]
При действии щелочей на растворы солей ртути (II) получается желтый осадок оксида ртути (II):
Hg(NO3)2 + 2NaOH = HgO + 2NaNO3 + H2O
Для восстановления сулемы до каломели используют в качестве восстановителя тетрахлоростаннит(II) водорода:
2HgCl2 + H2[SnCl4] = Hg2Cl2 + H2[SnCl6]
Hg2Cl2 + H2[SnCl4] = 2Hg + H2[SnCl6]
Водный раствор сулемы практически не проводит электрического тока. Сулема – одна из немногих солей, которая почти не диссоциирует в водном растворе на ионы. Это объясняется сильной поляризующей способностью иона Hg2+.
Соли ртути, в отличие от соединений кадмия и цинка, взаимодействуют с аммиаком иначе:
HgCl2 + 2NH3 = HgNH2Cl + NH4Cl
Сульфид ртути.
Сульфид ртути(II) — неорганическое бинарное соединение ртути с серой, имеющее химическую формулу HgS. Нерастворимо в воде.
Существует в двух модификациях: α-HgS (тригональная сингония) и β-HgS (кубическая сингония). Первая, ярко-красная, при нагревании свыше 345 °C превращается во вторую, имеющую чёрный цвет. В природе α-модификация распространена в виде рудного ртутного минерала киновари, β-модификация — минерал метациннабарит.
Не растворим в разбавленных кислотах. Реагирует с раствором сульфида натрия, царской водкой, горячей соляной кислотой, горячей азотной кислотой.
HgS + HNO3= HS + HgNO3
HgS +2HCl = HgCl2+ H2S
3HgS+2HNO3+6HCl = 3S+2NO+3HgCl2+4H2O
