Оксид и гидроксид цинка
Тема 28
Элементы IIБ группы: цинк, кадмий, ртуть
Общая характеристика.
Элементы этой подгруппы – полные электронные аналоги друг друга, каждый в своем периоде является последним элементом d-семейства, у них завершена d-электронная конфигурация, валентные электроны (n-1)d10ns2. На внешней электронной оболочке содержатся 2 электрона и 18 электронов на предыдущей оболочке. Цинк и его аналоги отличаются от d-элементов и в большей степени проявляют сходство с p-элементами больших периодов.
У атомов цинка, кадмия и ртути, как и у атомов меди, (n-1)d-подуровень целиком заполнен и вполне стабилен. Удаление из него электронов требует очень большой затраты энергии. Поэтому рассматриваемые элементы проявляют в своих соединениях максимальную степень окисления +2. Только ртуть образует соединения, в которых ее степень окисления равна +1.
Характерной особенностью элементов является их склонность к комплексообразованию (к.ч.= 4; 6).
В отличие от элементов главных подгрупп элементы подгруппы цинка труднее окисляются, проявляют меньшую реакционную способность и обнаруживают более слабые металлические свойства.
В подгруппе сверху вниз: возрастает атомный радиус, уменьшается температура плавления и кипения, возрастает электроотрицательность и электродный потенциал. Минимальная энергия ионизации наблюдается у кадмия (8,99 эВ), т.к. на свойствах ртути сказывается лантаноидное сжатие, в результате которого ее энергия ионизации возрастает до 10,43 эВ (у цинка 9,39 эВ).
Распространенности и основные минералы.
ZnS – цинковая обманка,
HgS – киноварь,
ZnCO3 – галмей,
CdS – гринокит.
Природные соединения цинка входят в состав полиметаллических сульфидных руд, которые содержат пирит FeS2, галенит PbS, халькопирит CuFeS2, и в меньшем количестве ZnS. Ртуть является редким элементом и встречается в самородном состоянии.
Металлический цинк, его получение, свойства и применение.
Серебристо-белый мягкий металл, на воздухе покрывается оксидной пленкой. Полиморфных модификаций не имеет, диамагнетик. Внешняя электронная конфигурация атома Zn 3d104s2. Степень окисления в соединениях +2. Нормальный окислительно-восстановительный потенциал, равный 0,76 в, характеризует Цинк как активный металл и энергичный восстановитель.
Для выделения цинка, полученный после обогащения концентрат ZnS подвергается обжигу, а образовавшийся оксид восстанавливается углем:
2ZnS + 3O2 = 2ZnO + 2SO2↑
ZnO + C = Zn + CO↑
Другой способ заключается в том, что руду, содержащую ZnS, обжигают, а затем обрабатывают разбавленной серной кислотой:
ZnO + H2SO4 = ZnSO4 + H2O
Полученный раствор сернокислого цинка подвергают электролизу.
По химической активности подгруппа цинка уступает щелочноземельным металлам. В подгруппе с ростом атомной массы химическая активность металлов падает, о чем свидетельствуют значения стандартных электродных потенциалов (см. выше). Цинк – химически активный металл, легко растворяется в кислотах и при нагревании – в щелочах:
Zn + 2HCl = ZnCl2 + H2↑ Zn + H2SO4(р-р) = ZnSO4 + H2↑
Эти реакции идут медленно, т.к. образующийся атомарный водород покрывает поверхность цинка.
Zn + 2H2SO4(конц.) = ZnSO4 + SO2↑ + H2O
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Металлический цинк вытесняет менее активные металлы и восстанавливает H2CrO4, HMnO4, соли железа (III) и олова (IV):
5Zn + 2KMnO4 + 8H2SO4(р-р) = 2MnSO4 + 5ZnSO4 + K2SO4 + 8H2O
Zn + CuSO4 = ZnSO4 + Cu
Применение цинка разнообразно. Из цинка готовят сплав с алюминием, медью, магнием, которые имеют промышленное значение. Значительная часть цинка идет на нанесение покрытий на железные и стальные изделия, которые защищают основной металл от коррозии.
Оксид и гидроксид цинка.
Оксид цинка – рыхлый белый порошок, желтеющий при нагревании, но при охлаждении снова становящийся белым, полупроводник. Оксид цинка амфотерен — реагирует с кислотами с образованием солей, при взаимодействии с растворами щелочей образует комплексные три- тетра- и гексагидроксицинкаты (Na2[Zn(OH)4], Ba2[Zn(OH)6]):
ZnO + 2HCl = ZnCl2 + H2↑
ZnO + 2NaOH + 2H2O 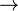 Na2[Zn(OH)4] + H2↑
Na2[Zn(OH)4] + H2↑
Оксид цинка растворяется в водном растворе аммиака, образуя комплексный аммиакат:
ZnO + 4NH3 + Н2O — [Zn(NH3)4](OH)2
При сплавлении с щелочами и оксидами металлов оксид цинка образует цинкаты:
ZnO + 2NaOH 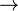 Na2ZnO2 + H2O
Na2ZnO2 + H2O
ZnO + CoO 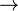 CoZnO2
CoZnO2
При сплавлении с оксидами бора и кремния оксид цинка образует стекловидные бораты и силикаты:
ZnO + B2O3 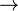 Zn(BO2)2
Zn(BO2)2
ZnO + SiO2 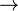 ZnSiO3
ZnSiO3
При температуре выше 1000°С восстанавливается до металлического цинка углеродом, угарным газом и водородом:
ZnO + C = Zn + CO
ZnO + CO = Zn + CO2
ZnO + H2 = Zn + H2O
С водой не реагирует. При взаимодействии с оксидами неметаллов образует соли, где является катионом:
2ZnO + SiO2 = Zn2SiO4
ZnO + B2O3 = Zn(BO2)2
Получается при горении металлического цинка:
2Zn + O2 = 2ZnO
при термическом разложении солей:
ZnCO3 = ZnO + CO2
Оксид цинка применяют для изготовления белой масляной краски (цинковые белила), в медицине и косметике (для изготовления различных мазей); значительная часть оксида цинка используется в качестве наполнителя резины.
Гидроксид цинка – бесцветное кристаллическое или аморфное вещество. При температуре выше 125°С разлагается:
Zn(OH)2 = ZnO + H2O
Гидроксид цинка проявляет амфотерные свойства, легко растворяется в кислотах и щелочах:
Zn(OH)2 + H2SO4(конц) = ZnSO4 + 2H2O
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
также легко растворяется в водном растворе аммиака с образованием гидроксида тетраамминцинка:
Zn(OH)2 + 4NH3 = [Zn(NH3)4](OH)2
Получается в виде осадка белого цвета при взаимодействии солей цинка со щелочами:
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
