Расчет горения топлива
3.4.1 Горение газообразного топлива
Горение газов происходит в объеме и относится к гомогенному горению. Оно может происходить как в кинетической, так и в диффузионной области.
3.4.1.1 Кинетическое горение
После того, как произошло воспламенение, наступает процесс распространения пламени, связанный с постоянной передачей тепла от сгоревших к новым порциям топлива. Подобная передача тепла определяется законами теплопроводности и диффузии, и сильно зависит от характера пламени. Если пламя распространяется в неподвижной смеси или смеси, движущейся ламинарно, то основной формой передачи тепла будет молекулярная теплопроводность. Подобный чисто теплопроводный процесс получил название нормального горения.
При турбулентном движении газо – окислительной смеси большую роль приобретает турбулентная диффузия. При некоторых условиях распространение пламени происходит с огромной скоростью и имеет характер взрывной волны. Подобное распространение пламени получило название детонационного горения или просто детонации.
Важнейшими факторами, влияющими на скорость распространения нормального горения, являются состав горючей смеси, предварительная температура подогрева смеси или отдельных ее компонентов и давление.
Для всех горючих газов существует оптимальное соотношение газа и воздуха, при котором скорость нормального горения достигает максимальной величины. При этом максимум скорости нормального горения никогда не соответствует стехиометрическому соотношению, а всегда смещен в сторону избыточного содержания газа в горючей смеси. Температура горения (или тепловыделение) достигает своего наибольшего значения именно при стехиометрическом соотношении.
Горение при турбулентном режиме более распространенный случай в металлургической практике, чем горение в спокойной или ламинарно движущейся среде. На скорость турбулентного горения и на состояние фронта горения большое влияние оказывает общий уровень турбулентности потока и сам процесс горения, поскольку при определенных условиях возникает неустойчивость фронта горения.
3.4.1.2 Диффузионное горение
В настоящее время широко распространен диффузионный метод сжигания газообразного топлива, при котором смешение и горение происходят в одном объеме. И при кинетическом, и при диффузионном горении образуется фронт горения, в котором горючее и окислитель находятся в стехиометрическом соотношении. Достижение стехиометрического соотношения, которое при наличии постоянного поджигателя (в металлургических печах всегда есть поджигатель) обеспечивает необходимые условия для протекания процесса горения, зависит от характера перемешивания топлива с воздухом. Поэтому процессы смешения при диффузионном горении играют первостепенную роль.
Диффузионные пламена имеют сложный турбулентный характер и изучены пока недостаточно.
3.4.2 Горение жидкого топлива
В условиях промышленных печей жидкое топливо сжигают в распыленном состоянии.
Процесс горения жидкого топлива складывается из следующих стадий:
- распыливание,
- воспламенение, которому предшествует и способствует процесс смешения, подогрева и испарения,
- горение капли жидкого топлива.
Процесс распыливания топлива основан на дроблении жидкости распылителем. Дробление будет происходит в том случае, если давление движущегося распылителя будет превышать действие поверхностного натяжения.
Воспламенение жидкого топливапроисходит так: жидкое топливо, попав в среду с высокой температурой, начинает испаряться. Около поверхности капли образуется паро – воздушная смесь, которая воспламеняется первой. Температура, при которой происходит воспламенение паро – воздушной смеси, называется температурой вспышки топлива. Обычно температура кипения жидкого топлива ниже температуры воспламенения.
Горение капли. Все процессы, из которых складывается горение топлива, совершаются или на поверхности, или около поверхности капли.
Температура кипения жидких топлив всегда ниже температуры воспламенения, поэтому горение жидкого в основном происходит в паровой фазе. Процессы горения паро – воздушной смеси и испарения тесно связаны между собой. При горении жидкого топлива осуществляется теплообмен между газовой средой и поверхностью жидкости, т. е. между средами, находящимися в разных агрегатных состояниях, что придает всему процессу гетерогенный характер
Общее время горения капли находят из анализа изменения размеров капли в связи с процессами тепло – и массопереноса. Оно прямо пропорционально плотности, размеру капли и скрытой теплоте капли и обратно пропорционально теплопроводности капли, а также перепаду температур между газовой средой и поверхностью капли.
3.4.3 Горение твердого топлива
Горение твердого топлива относится к гетерогенному.
Процесс горения твердого топлива складывается из следующих стадий:
- подогрев и подсушка топлива,
- процесс пирогенного разложения топлива с выделением летучих и образованием коксового остатка,
- горение летучих,
- горение коксового остатка.
Процесс выделения летучих, т. е. горючей смеси различных газообразных составляющих – Н2, СО, СН4, СmHn и др., протекает при подогреве топлива до 200 ˚С и выше. Температура начала выделения летучих зависит от возраста угля. Чем "старше" уголь, чем выше в нем содержание углерода, тем при более высокой температуре начинается процесс выделения летучих. Летучие в процессе горения твердого топлива играют важную роль, которая различна при горении кускового топлива и угольной пыли.
При горении кускового топлива летучие выделяются при сравнительно умеренных температурах, смешиваются с воздухом и воспламеняются первыми. Таким образом, горением летучих начинается процесс горения всего топлива. Тепло, выделяемое при горении летучих, способствует повышению температуры и дальнейшему развитию процесса горения. Горение углерода начинается уже после завершения выхода летучих. Процесс горения самого углерода продолжителен и он определяет время протекания всего процесса.
При сжигании угольной пыли в связи с огромной суммарной поверхностью угольных частиц основная масса летучих не успевает выделиться до момента воспламенения частиц, поэтому летучие сгорают вместе с углеродом.
3.4.4 Расчеты горения топлива
При сжигании топлива в промышленных печах в качестве окислителя используют кислород, содержащийся в воздухе или в обогащенном кислородом дутье. В результате горения образуются продукты сгорания и развивается определенная температура.
3.4.4.1 Определение расхода воздуха
Расход воздуха можно определять в объемных единицах и в единицах массы. В объемных единицах рассчитывают газообразное топливо, в единицах массы – жидкое и твердое топливо.
В качестве примера рассмотрим горение топлива, состоящего из 98 % СН4 и
2 % N2.
СН4 + 2 О2 = СО2 + 2 Н2О,
из которой следует, что для сжигания 1 кмоль СН4 требуется 2 кмоль О2. Но объем 1 кмоль любого газа одинаков для всех газов и при нормальных условиях равен 22,4 м3, следовательно для сжигания 1 м3 СН4 требуется 2 м3 О2. В рассматриваемом примере в 1 м3 газа содержится 0,98 м3 СН4, для сжигания которого потребуется 0,98 ∙ 2 = 1,96 м3 О2. В сухом воздухе доля кислорода по объему составляет 21 %, а остальные 79 % приходится практически полностью на азот. Значит, количество азота в воздухе в 79/21=3,76 раза больше количества кислорода. Поэтому расход воздуха для сжигания 1 м3 газа указанного состава будет равен 1,96 + 1,96 ∙ 3,76=1,96 + 7,38 = 9,34 м3.
При горении топлива полученные на основе химических реакций количества кислорода и воздуха представляют те наименьшие количества, которые необходимы для полного окисления единицы горючего вещества. Такое наименьшее необходимое количество воздуха называют теоретическим. на прктике для более полного сжигания требуется подавать количество воздуха, несколько превышающее теоретическое. Величина показывающая отношение действительного расхода воздуха к теоретическому расходу называют коэффициентом расхода воздуха.
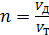 (3.34)
(3.34)
Изменение величины коэффициента расхода воздуха влечет за собой изменение количества воздуха, подаваемого для горения. Так, для рассмотренного выше примера горения газа при n=1,2 потребуется
1,96 ∙ 1,2 = 2,35 м3 О2 и 2,35 + 2,35 ∙ 3,76 = 11,19 м3 воздуха.
3.4.4.2Определение количества и состава продуктов сгорания
Рассмотрим пример горения газа (98 % СН4 и 2 % N2) сначала при коэффициенте расхода воздуха, равным 1. Определим последовательно количества каждой составляющей продуктов сгорания. При сжигании 1 м3 СН4 образуется 1 м3 СО2 и 2 м3 Н2О, а при сжигании 0,98 м3 СН4 образуется 0,98 м3 СО2 и 1,96 м3 Н2О.
Кроме того, вносится азота:
с воздухом . . . . . 1,96 ∙ 3,76 = 7,38
с газом . . . . . . . . . . . . . . . . . . . 0,02
––––––––––––––––––––––
Итого . . . . . 7,40
Полное количество продуктов сгорания составит 0,98 + 1,96 + 7,40 = 10,34 м3.
Состав продуктов сгорания будет следующий, %:
СО2. . . . . . . . 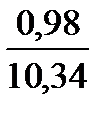 ∙ 100 = 9,45
∙ 100 = 9,45
Н2О. . . . . . . . 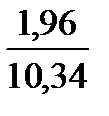 ∙ 100 = 18,9
∙ 100 = 18,9
N2. . . . . . . . . 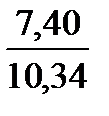 ∙ 100 = 71,65
∙ 100 = 71,65
–––––––––––––––––––––––––––––––
Итого. . . . . . . . . . . . . 100
При сжигании газа с коэффициентом расхода воздуха, большем единицы, количество и состав продуктов сгорания изменяются. Например, при n = 1,2 в продуктах сгорания рассматриваемого состава будет 0,98 м3 СО2; 1,96 м3 Н2О; 1,96 ∙ 1,2 – 1,96 = 0,39 м3 О2 и 1,96 ∙ 1,2 ∙ 3,76 + 0,02 = 8,86 м3 N2.
Полное количество продуктов сгорания составит 0,98 + 1,96 + 0,39 + 8,86 = 12,19 м3.
Состав продуктов сгорания будет следующий, %:
СО2. . . . . . . . 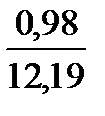 ∙ 100 = 8,05
∙ 100 = 8,05
Н2О. . . . . . . . 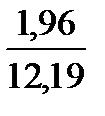 ∙ 100 = 16,1
∙ 100 = 16,1
О2. . . . . . . . . . 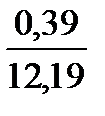 ∙ 100 = 3,2
∙ 100 = 3,2
N2. . . . . . . . . 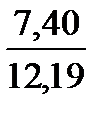 ∙ 100 = 72,65
∙ 100 = 72,65
–––––––––––––––––––––––––––––––
Итого. . . . . . . . . . . . . 100
При расчетах горения необходимо составлять материальный баланс, определяя массы исходных веществ и образующихся продуктов сгорания. Для рассмотренного выше примера горения в воздухе газа ( 98 % СН4 и 2 % N2) при n = 1 материальный баланс будет выглядеть следующим образом:
Поступило, кг: Получено, кг:
СН4. . . . .0,98 ∙ 16 / 22,4 = 0,7 СО2. . . . . . 0,98 ∙ 44 / 22,4 = 1,925
О2. . . .. . .1,96 ∙ 32 / 22,4 = 2,8 Н2О. . . . . .1,96 ∙ 18 / 22,4 = 1,575
N2. . (7,38 + 0,02) ∙ 28 / 22,4 = 9,25 N2. . . . . . . . 7,4 ∙ 28 / 22,4 = 9,25
–––––––––––––––––––––––––––––– ––––––––––––––––––––––––––––––
Итого. . . . . . . . . . 12,75 Итого . . . . . . . . . . . . 12,75
При составлении материального баланса погрешность не должна превышать 5 %.
3.4.4.3Определение температуры горения
Под температурой горения понимают ту температуру,которую приобретают продукты сгорания в результате сообщения им тепла, выделенного при сжигании. Различают теоретическую и калориметрическую температуры горения.
Теоретическую температуру горения tт определяют с учетом процессов диссоциации, протекающих при образовании продуктов сгорания:
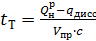 , (3.35)
, (3.35)
где 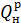 - теплота сгорания топлива, кДж/м3 или кДж/кг;
- теплота сгорания топлива, кДж/м3 или кДж/кг;
qдисс – тепло, израсходованноеина процессы диссоциации, кДж/м3 или кДж/кг;
Vпр – объем продуктов сгорания, образующихся при сгорании единицы топлива,
с – объемная теплоемкость продуктов сгорания, кДж/(м3∙ град) или
кДж/(кг ∙ град).
Калориметрическую температуру tк определяют из условия полного сгорания топлива и использования всего выделившегося при горении тепла только на повышение температуры продуктов сгорания при адиабатных условиях (отсутствие теплообмена с внешней средой) и n = 1.
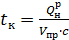 (3.36)
(3.36)
При подогретом воздухе (или топливе) калориметрическую температуру определяют по выражению:
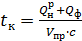 , (3.37)
, (3.37)
где Qф – физическое тепло подогретых воздуха и топлива.
Газообразные продукты сгорания любого топлива представляют собой смесь различных газообразных составляющих. Каждой из этих составляющих при той или иной температуре присуща определенная величина теплоемкости. Это дает возможность определить теплоемкость теплоемкость продуктов сгорания в целом для соответствующей температуры. Например, теплоемкость продуктов сгорания, состоящих из 9,45 % СО2, 18,9 % Н2О и 71,65 % N2 при температуре 1500 ˚ С может быть определена следующим образом.
Объемные теплоемкости при этой температуре составят :
для СО2 2,3636 кДж/(м3∙ град),
для Н2О 1,8389 кДж/(м3∙ град),
для N2 1.447 кДж/(м3∙ град).
В 1 м3продуктов сгорания содержится 0,0945 м3 СО2, 0,189 м3 Н2О, 0,7165 м3 N2.
Следовательно, теплоемкость 1 м3 продуктов сгорания будет равна:
СО2. . . . . .2,3636 ∙ 0,0945 = 0,223
Н2О . . . . . . 1,8389 ∙ 0,189 = 0,348
N2 . . . . . . . .1,447 ∙ 0,7165 = 1,035
–––––––––––––––––––––––––––––
Итого . . . . . .. . . . . . 1,606
Кроме теплоемкостей пользуются также величинами энтальпий. Энтальпия представляет собой произведение теплоемкости газа при постоянном давлении на температуру:
i = срt кДж/м3.
Например, энтальпия СО2 при температуре 1500 ˚ С равна:
i (СО2) = 2,3636 ∙ 1500 = 3545,34 кДж/м3.
3.4.4.4Основные формулы для расчета горения топлива
Сведем все формулы, необходимые для расчета горения топлива, в единую таблицу.
Таблица 3.2 – Основные формулы для расчета горения топлива
| Искомый параметр | Жидкое и твердое топливо | Газообразное топливо |
| Пересчет на рабочий состав | 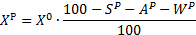 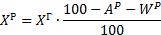 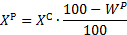 | 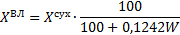 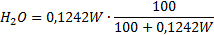 |
| Состав смеси | 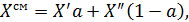 где где 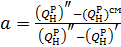 | |
| Низшая теплота сгорания | 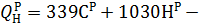 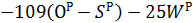 | 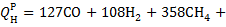 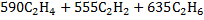 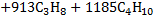 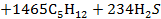 |
| Таблица 3.2 Продолжение | ||
| Расход кислорода на горение при n=1 | V(О2)=0,01(1,867СР+5,6НР+ +0,7(SР-ОР)) | V(О2)=0,01(0,5(СО+Н2+3Н2S)+∑(n+m/4)СnНm) |
| Расход сухого воздуха | VВ=n(1+k)V(О2), где k=79/21=3,76;n – коэффициент расхода воздуха | |
| Объемы компонентов продуктов сгорания | V(RО2)=0,01(1,867СР+0,7SР) RО2=СО2+SО2 V(Н2О)=0,01(11,2НР+ +1,242WР) V(N2)=0,008NР+nkV(О2) V(О2)'=(n-1)V(О2) | V(RО2)=0,01(СО2+SО2+СО+ +Н2S+∑nСnНm) V(Н2О)=0,01(Н2О+Н2+ Н2S+ +0,5∑mСnНm) V(N2)=0,01N2+nkV(О2) V(О2)'=(n-1)V(О2) |
| Объем продуктов сгорания | VПС= V(RО2)+ V(Н2О)+ V(N2)+ V(О2)' | |
| Калориметрическая температура горения | 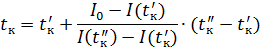 | |
| Энтальпия продуктов сгорания | Истинная 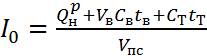 При температуре tК' При температуре tК' 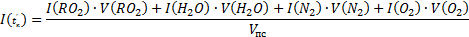 | |
| Действительная температура продуктов сгорания | tД=ηпирtК, где ηпир- пирометрический коэффициент для топочных камер ηпир=0,95 для мартеновских печей ηпир=0,85 – 0,9 для садочных печей ηпир=0,8 – 0,85 для проходных и протяжных печей ηпир=0,7 – 0,75 |
