Атомно-молекулярное учение
Представление об атомах, как конструкционных элементах вещественного мира, зародилось еще в древней Греции (Левкипп, Демокрит, 1У-Ш вв. до н. э.). Но только в конце XVIII — начале XIX в. было создано атомно-молекулярное учение. Важнейший вклад в обобщение накопленного материала был сделан М. В. Ломоносовым.
Атомно-молекулярное учение включает в себя следующие основные положения:
1. Все вещества не являются сплошными, а состоят из частиц (молекул, атомов, ионов).
2. Молекулы состоят из атомов (элементов).
3. Различия между веществами определяются различиями образующих их частиц, которые отличаются друг от друга составом, строением и свойствами.
4. Все частицы находятся в постоянном движении, скорость которого увеличивается при нагревании.
Атом — наименьшая частица химического элемента, являющаяся носителем его свойств. Это электронейтральная микросистема, поведение которой подчиняется законам квантовой механики.
Химический элемент — вид атомов, имеющих одинаковый положительный заряд ядра и характеризующихся определенной совокупностью свойств.
Изотопы — атомы одного элемента, различающиеся массой (количеством нейтронов в ядре).
Любой химический элемент в природе представлен определенным изотопным составом, поэтому его масса рассчитывается как некоторая средняя величина из масс изотопов с учетом их содержания в природе.
Молекула— наименьшая частица вещества, являющаяся носителем его свойств и способная к самостоятельному существованию.
Простое вещество — вещество, молекулы которого состоят только из атомов одного элемента.
Аллотропия— способность элемента образовать простые вещества, имеющие различный состав, строение и свойства.
Разновидности аллотропных модификаций определяются:
• различным числом атомов элемента в составе молекулы простого вещества, например, кислород (О2) и озон (О3).
• различиями в строении кристаллической решетки простого вещества, например, соединения углерода: графит (плоская, или двумерная, решетка) и алмаз (объемная, или трехмерная решетка).
Сложное вещество — вещество, молекулы которого состоят из атомов разных элементов.
Сложные вещества, состоящие только из двух элементов, называются бинарными, например:
Ø оксиды: CO, CO2, CaO, Na2O, FeO, Fe2O3;
Ø галогениды: NaCl, CaF2, FeBr3;
Ø сульфиды: ZnS, Na2S, CS2;
Ø гидриды: CaH2, LiH, NaH;
Ø нитриды: Li3N, Ca3N2, AlN;
Ø фосфиды: Li3P, Mg3P2, AlP;
Ø карбиды: Be2C, Al4C3, Ag2C2;
Ø силициды: Ca2Si, Na4Si.
Сложные соединения, состоящие более чем из двух элементов, относятся к основным классам неорганических соединений. Это гидроксиды(кислоты и основания) и соли, в том числе комплексные соединения.
Атомы и молекулы имеют абсолютную массу, например, масса атома С12 равна 2·10-26 кг.
Такими величинами пользоваться на практике неудобно, поэтому в химии принята относительная шкала масс.
Атомная единица массы (а. е. м.) равна 1/12 массы изотопа С12.
Относительная атомная масса (Аr — безразмерная величина) равна отношению средней массы атома к а. е. м.
Относительная молекулярная масса (Мr — безразмерная величина) равна отношению средней массы молекулы к а. е. м.
Моль (ν — «ню» или n) — количество вещества, содержащее столько же структурных единиц (атомов, молекул или ионов), сколько атомов содержится в 12 г изотопа С12.
Число Авогадро — число частиц (атомов, молекул, ионов и др.), содержащееся в 1 моле любого вещества.
NA = 6,02·1023.
Более точные значения некоторых фундаментальных констант приводятся в таблицах приложения.
Молярная масса вещества (М) — это масса 1 моля вещества. Она рассчитывается как отношение массы вещества к его количеству:
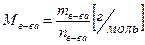 (1)
(1)
Молярная масса численно равна Аr (для атомов) или Мr (для молекул).
Из уравнения 1 можно определить количество вещества, если известны его масса и молярная масса:
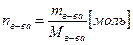 (2)
(2)
Молярный объем (Vm для газов) — объем одного моля вещества. Рассчитывается как отношение объема газа к его количеству:
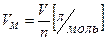 (3)
(3)
Объем 1 моля любого газа при нормальных условиях (Р = 1 атм = 760 мм. рт. ст. = 101,3 кПа; T = 273ТС = 0°С) равен 22,4 л.
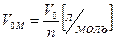 (4)
(4)
Плотность вещества равна отношению его массы к объему.
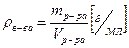 (5)
(5)
