Построение кривой ликвидуса системы KNO3– NaNO3
Министерство образования и науки Республики Казахстан
Евразийский национальный университет им. Л.Н.Гумилева
Методические указания к лабораторным занятиям
по курсу «Основы физико-химического анализа»
Астана 2015
Работа № 1.
Пересчет концентраций
Способы выражения состава системы довольно разнообразны. Остановимся лишь на важнейших из них. Отношение массы какого-либо вещества к массе всей смеси называется массовой долей данного вещества в смеси. Массовые доли, умноженные на 100, дают массовые проценты. Сумма массовых долей равна единице, а сумма массовых процентов равна ста. Мольной (молекулярной) долей называется отношение числа молей данного вещества к общему числу молей всех веществ в смеси. Умножая мольные доли на 100, получим мольные (молекулярные) проценты. Мольная доля указывает, какая часть от одного моля смеси приходится на данное вещество, мольные проценты указывают на аналогичную часть от 100 молей смеси. Сумма мольных долей равна единице, а сумма мольных процентов - 100. Молярная, или объемно-молекулярная, концентрация указывает, сколько молей данного вещества находится в единице объема. Чаще всего за единицу объема принимается 1 литр. Кроме указанных способов выражения концентрации, в некоторых специальных случаях встречаются и другие. Например, растворимость какого-либо либо вещества часто выражают количеством этого вещества, приходящимся на определенное количество растворителя, причем количества растворенного вещества и растворителя измеряют в массовых и объемных единицах, в молях и т. д. Иногда состав указывают в объемных долях (объемных процентах). Для смеси газов объемная доля - это отношение парциального объема данного газа к общему объему смеси. Под парциальным объемом понимается объем какого-либо газа, входящего в состав газовой смеси, причем этот объем рассматривается при давлении и температуре смеси. Для смеси идеальных газов объемные доли совпадают с мольными. Иногда полезно строить диаграммы состав - свойство при разных способах выражения концентрации. Поэтому предлагается несколько заданий на пересчет концентраций.
Пересчет из массовых долей (процентов) в мольные (атомные) доли,
(проценты)
Допустим, что состав системы В - А выражен в массовых долях. Обозначим содержание компонента В – хВ мас. долей, компонента А - xA мас. долей, а Хв и ХА - их мольные доли в смеси, Мв и МА - их молекулярные массы.
В одной массовой доле смеси содержится: молей компонента 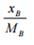 В и
В и 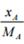 молей компонента А. Общее число молей равно:
молей компонента А. Общее число молей равно:

Отсюда мольные доли выразятся формулами:
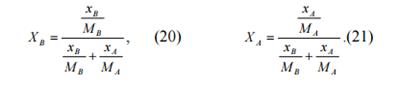
Так как xA + xв = 1, после преобразований получим:
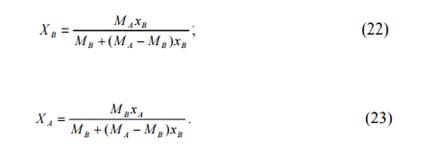
Массовые доли можно определить по мольным (атомным) долям по уравнениям:
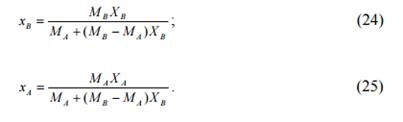
В случае пересчета массовых долей в атомные доли и обратно в формулы (22-25) вместо молекулярных масс (МВ и МА) подставляются значения атомных масс (Аа и АВ) простых веществ.
Особенно удобным является выражение состава диаграммы состояния в мольных (атомных) долях (процентах) в случаях, если в системах образуются химические соединения. Тогда легко определяются стехиометрические формулы соединений: достаточно к числам, указывающим мольный (атомный) состав, подобрать наименьшие целые числа.
По этой причине в большинстве исследований, проводимых в настоящее время, состав выражается в мольных (атомных) процентах. Однако встречается также выражение концентрации в эквивалентных процентах, особенно для выражения состава систем, компоненты которых образованы металлами в различном валентном состоянии (или для взаимных систем). Для нахождения стехиометрических формул образующихся в этих системах соединений значения эквивалентных процентов делятся на произведение nW, где п - число атомов металла, W- его валентность в соответствующем соединении. Затем находятся наименьшие целые числа, соответствующие найденным числам, которые и определяют формулу образующегося соединения.
В качестве упражнений предлагается произвести следующие пересчеты.
Произвести пересчет состава системы AgCN - NaCN из массовых проценов в молекулярные, исходя из данных, представленных в табл. 2. Заполнить графу молекулярных процентов (графа 2).
Таблица 2
Данные для пересчета состава системы
| AgCN мас. % | AgCN, мол. % | Температура, С° | Твердые фазы | Характер точек | ||
| начала кристаллизаци и | конца кристаллизаци и | плавл. эвтектик и | ||||
| - | - | |||||
| - | ||||||
| - | ||||||
| - | ||||||
| - | ||||||
| - | ||||||
| - | ||||||
| - | - |
| - | ||||||
| 73,2 | - | - | Дистектика (максимум на линии ликвидуса) | |||
Построить по пересчитанным данным диаграмму состояния системы на миллиметровой бумаге. В соответствие с построенной диаграммой системы заполнить графы 6 и 7 табл. 2. В графе 6 указать твердые фазы, кристаллизующиеся первично из расплава. В графе 7 указать дистектические (точки максимума), эвтектические точки. Если в системе образуется химическое соединение, определить его стехиометрической состав. Определить вариантность состояний системы, соответствующих разным точкам диаграммы.
Работа № 2.
Построение кривой ликвидуса системы KNO3– NaNO3
