Квантово-механическое объяснение строения атома
Химические свойства элементов определяются строением электронных оболочек атома, так как при химических реакциях ядра атомов не претерпевают изменений.
Современная теория строения атома основана на законах, описывающих поведение микрообъектов – микрочастиц, элементарных частиц и электронов в том числе.
Представление о поведении электронов как микрочастиц основано на следующих трех положениях: 1) квантовый характер энергетических изменений; 2) двойственное корпускулярно-волновое поведение; 3) неопределенность положения и скорости при одновременном их измерении.
Квантовый характер энергетических изменений.В системе микрообъектов энергия поглощается и испускается не непрерывно, а дискретно, отдельными порциями – квантами.
Энергия электрона в атоме не может быть произвольной, она принимает только определенные значения, кратные числам квантов:
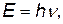 | (1.1) |
где h – постоянная Планка, h=6,626·10-34 Дж·с.
Частота колебаний 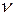 и длина волны λ связаны соотношением:
и длина волны λ связаны соотношением: 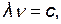
где с – скорость света, с=2,997·108 м/с.
Из этих соотношений, в частности, следует, что чем меньше длина волны или чем больше частота колебаний, тем больше энергия кванта и наоборот. Поэтому ультрафиолетовые лучи обладают большей энергией, чем лучи видимого света.
Квантовый характер энергетических изменений особенно ярко проявляется в спектрах веществ и, в первую очередь, – в атомных спектрах. Атомные спектры состоят из отдельных спектральных линий. Каждая спектральная линия характеризуется определенной частотой колебаний 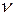 света и соответствует строго определенному энергетическому квантовому переходу между различными уровнями энергии:
света и соответствует строго определенному энергетическому квантовому переходу между различными уровнями энергии:
h 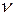 =E2–E1. =E2–E1. | (1.2) |
Атомные спектры возникают при переходах между энергетическими уровнями внешних электронов атомов.
Каждому элементу отвечает свой спектр, т.е. каждому виду атомов присущ свой характеризующий его прерывистый (дискретный) ряд значений внутренней энергии. Отсюда следует невозможность для атома непрерывно изменять свое состояние и в связи с этим невозможность как поглощать, так и испускать энергию любыми, в том числе бесконечно малыми, порциями.
Атом элемента, поглотив энергию, через некоторый очень короткий промежуток времени снова самопроизвольно возвращается в первоначальное состояние, излучая поглощенную энергию в количестве одного кванта 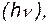 т.е. энергии определенной частоты или длины волны.
т.е. энергии определенной частоты или длины волны.
Корпускулярно-волновое поведение. Электроны – микрочастицы, обладающие рядом свойств, которые присущи и волнам и частицам. Корпускулярные свойства (свойства частицы) электрона выражаются в его неспособности дробиться, в наличии массы и способности оказывать давление. Волновые свойства выражаются в особенностях движения, в дифракции и интерференции. Энергия кванта излучения связана с частотой излучения уравнением Планка (1.1). В то же время масса частицы m связана с ее энергией Е и скоростью с формулой Эйнштейна (Е=mс2). Двойственность свойств частицы (электрона) отражается соотношением между скоростью частицы, ее массой и длиной:
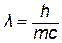 . . | (1.3) |
Соотношение «волна-частица» таково, что с уменьшением массы частицы ее волновые свойства усиливаются, а корпускулярные ослабляются, а с увеличением частоты и уменьшением длины волны происходит усиление корпускулярных свойств.
Неопределенность положения и скорости. В микромире нельзя определить точно положение и скорость частиц, т.е. микрочастицы вообще не имеют вполне точных положений и скоростей. Следовательно, если невозможно одновременно установить местонахождение в пространстве и скорость движения электронов, то нельзя точно описать размеры и формы их орбиты, а также размер и форму атома. Все, что можно сказать о положении электрона в атоме, – это только вероятность его нахождения в какой-либо области пространства вблизи ядра.
Наиболее распространенным является представление электрона в виде зарядного (электронного) облака, т.е. области пространства вокруг ядра атома, где находится преобладающая часть заряда и массы электрона.
Для характеристики энергетического состояния электрона в атоме квантовая механика пользуется системой квантовых чисел.
Главное квантовое число n. Электроны, движущиеся вокруг атома, группируются в энергетические уровни (оболочки). Принадлежность электрона к тому или иному энергетическому уровню определяется главным квантовым числом n. Главное квантовое число принимает значения 1, 2, 3, 4, 5, …..∞. Значение главного квантового числа соответствует номеру периода в периодической системе, для всех известных элементов n изменяется от 1 до 7. Энергетические уровни имеют буквенные обозначения: K (n=1), L (n=2), M (n=3), N (n=4), O (n=5), P (n=6), Q (n=7).
Главное квантовое число определяет энергию электрона, находящегося на данном энергетическом уровне, и размеры электронного облака.
Побочное (орбитальное) квантовое числоI. Электроны каждого уровня группируются в подуровни, причем число возможных подуровней равно номеру уровня и определяется побочным,илиорбитальным, квантовым числом(I). Побочное (орбитальное) квантовое число I может принимать значения от нуля до n–1 (n≤1).
Необходимость введения побочного квантового числа подтверждается изучением спектра атома водорода. Спектральные линии, отвечающие переходам с одного уровня на другой, часто состоят из нескольких очень близко расположенных отдельных линий. Это указывает на незначительное различие в энергии электронов одного и того же энергетического уровня. Поэтому уровни, кроме первого, разделяют на подуровни, которые обозначают буквами s, p, d, f соответственно значениям I.
| Подуровень… | s | p | d | f |
| Орбитальное квантовое число, I… |
Первый энергетический уровень (n=1) содержит 1 подуровень – 1s; второй (n =2) – два подуровня – 2s, 2p; третий (n=3) – три подуровня – 3s, 3p, 3d; четвертый (n=4) – 4s, 4p, 4d, 4f и т.д. Число подуровней в каждом данном уровне равно главному квантовому числу.
