Физические и химические свойства. Схемы строения различных модификаций углерода a: алмаз, b: графит, c: лонсдейлит d: фуллерен — бакибол C60
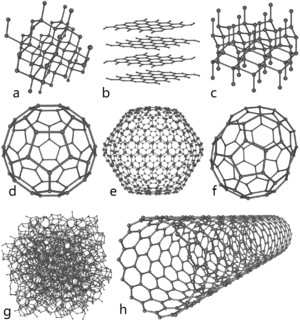
Схемы строения различных модификаций углерода
a: алмаз, b: графит, c: лонсдейлит
d: фуллерен — бакибол C60, e: фуллерен C540, f: фуллерен C70
g: аморфный углерод, h: углеродная нанотрубка
Конфигурация внешней оболочки атома углерода 2s22p2. Для него характерно образование четырех ковалентных связей, обусловленное возбуждением внешней электронной оболочки до состояния 2sp3. Поэтому углерод способен в равной степени как притягивать, так и отдавать электроны. Число валентных электронов углерода и число валентных орбиталей одинаково - это одна из причин устойчивости связи между атомами углерода.
Уникальная способность атомов углерода соединяться между собой с образованием прочных и длинных цепей и циклов привела к возникновению громадного числа разнообразных соединений углерода, изучаемых органической химией. В соединениях углерод проявляет степени окисления -4; +2; +4. При обычных условиях углерод химически инертен (неактивен), при высоких температурах он соединяется со многими элементами, проявляя сильные восстановительные свойства.
Все формы углерода устойчивы к щелочам и кислотам и медленно окисляются только очень сильными окислителями (хромовая смесь, смесь концентриров. HNO3 и KCIO3 и др.). Аморфный углерод реагирует с фтором при комнатной температуре, графит и алмаз - при нагревании. Непосредственно соединение углерода с хлором происходит в электрической дуге; с бромом и йодом углерод не реагирует. Из оксигалогенидов общей формулы COX2 (где Х - галоген) наиболее известная хлорокись COCI2 (фосген). При температурах выше 1000°С углерод взаимодействует со многими металлами, давая карбиды (тугоплавкие твёрдые вещества, не растворимы ни в одном из известных растворителей). Все формы углерода при нагревании восстанавливают окислы металлов с образованием свободных металлов (Zn, Cd, Cu, Pb и др.) или карбидов. Углерод реагирует при температурах выше 600-800°С с водяным паром и углекислым газом. Все формы углерода нерастворимы в обычных неорганических и органических растворителях, но растворяются в некоторых расплавленных металлах (например, Fe, Ni, Co).
Народнохозяйственное значение
Углерод определяется тем, что свыше 90 % всех первичных источников потребляемой в мире энергии приходится на органическое топливо, главенствующая роль которого сохранится и на ближайшие десятилетия, несмотря на интенсивное развитие ядерной энергетики. Только около 10% добываемого топлива используется в качестве сырья для основного органического синтеза и нефтехимического синтеза, для получения пластичных масс и др.
Углерод в организме
Углерод - важнейший биогенный элемент, составляющий основу жизни на Земле, структурная единица огромного числа органических соединений, участвующих в построении организмов и обеспечении их жизнедеятельности (биополимеры, а также многочисленные низкомолекулярные биологически активные вещества - витамины, гормоны, медиаторы и др.). Значительная часть необходимой организмам энергии образуется в клетках за счет окисления углерода. Возникновение жизни на Земле рассматривается в современной науке как сложный процесс эволюции углеродистых соединений.
Уникальная роль углерода в живой природе обусловлена его свойствами, которыми в совокупности не обладает ни один другой элемент периодической системы. Между атомами углерода, а также между углеродом и другими элементами образуются прочные химические связи, которые, однако, могут быть разорваны в сравнительно мягких физиологических условиях (эти связи могут быть одинарными, двойными и тройными). Углерод способен образовывать 4 равнозначные валентные связи с другими атомами. Он создает возможность для построения углеродных скелетов различных типов - линейных, разветвленных, циклических. Показательно, что всего три элемента - С, О, Н - составляют 98 % общей массы живых организмов. Этим достигается определенная экономичность в живой природе: при практически безграничном структурном разнообразии углеродистых соединений небольшое число типов химических связей позволяет намного сократить количество ферментов, необходимых для расщепления и синтеза органических веществ. Особенности строения атома углерода лежат в основе различных видов изомерии органических соединений (способность к оптической изомерии оказалась решающей в биохимической эволюции аминокислот, углеводов и некоторых алкалоидов).
Согласно гипотезе А. И. Опарина, первые органические соединения на Земле имели абиогенное происхождение (превращение неживого в живое). Источниками углерода служили (СН4)и цианистый водород (HCN),содержавшиеся в первичной атмосфере Земли. С возникновением жизни единственным источником неорганического углерода, за счет которого образуется всё органическое вещество биосферы, является углерода двуокись (СО2),находящийся в атмосфере, а также растворенная в природных водах в виде НСО3. Наиболее мощный механизм усвоения (ассимиляция) углерода (в форме СО2) - фотосинтез - осуществляется повсеместно зелеными растениями. На Земле существует и эволюционно более древний способ усвоения СО2 путем хемосинтеза; в этом случае микроорганизмы - хемосинтетики используют не лучистую энергию Солнца, а энергию окисления неорганических соединений. Большинство животных потребляют углерод с пищей в виде уже готовых органических соединений. В зависимости от способа усвоения органических соединений принято различать автотрофные (сами синтезируют пищу) и гетеротрофные (поглощают уже готовую пищу) организмы. Применение для биосинтеза белка и других питательных веществ микроорганизмов, использующих в качестве единственного источника углерода, углеводороды нефти, - одна из важных современных научно - технических проблем.
Помимо стабильных изотопов углерода, в природе распространен радиоактивный 14С (в организме человека его содержится около 0,1мккюри). С использованием изотопов углерода в биологических и медицинских исследованиях связаны многие крупные достижения в изучении обмена веществ и круговорота углерода в природе. Так, с помощью радиоуглеродной метки была доказана возможность фиксации Н14СО3 растениями и тканями животных, установлена последовательность реакции фотосинтеза, изучен обмен аминокислот, прослежены пути биосинтеза многих биологически активных соединений и т. д. Применение 14С способствовало успехам молекулярной биологии в изучении механизмов биосинтеза белка и передачи наследственной информации. Определение удельной активности 14С в углеродсодержащих органических остатках позволяет судить об их возрасте, что используется в палеонтологии и археологии.
