ІІ. Ознайомлення з процесами, які відбуваються при роботі гальванічних елементів; вимірювання різниці потенціалів на електродах гальванічного елемента.
Для досліджень пропонуються гальванічні елементи по яких виконані розра-хунки на попередньому етапі роботи.
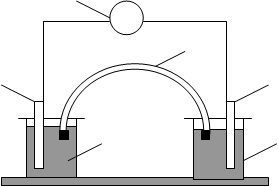 Для виконання дослідів треба скласти гальванічний елемент згідно зі схемою на рисунку. 1
Для виконання дослідів треба скласти гальванічний елемент згідно зі схемою на рисунку. 1
V Рис.1. Схема гальванічного елемента:
6 1 – вольтметр; 2,3 - електроди; 4, 5–
2 3 електроліти; 6 – електролітичний
ключ
4 5
Для цього слід зачистити поверхню металевих електродів і опустити їх у розчини відповідних електролітів. Два стакани з електролітами сполучити електрохімічним ключем (U-подібною трубкою, заповненою насиченим розчином КСІ). Контакти вимірювального приладу і зразків з¢єднати з електродами, попередньо виявити полярність за значеннями стандартних потенціалів з урахуванням схеми гальванічного елемента. Зверніть увагу на концентрації розчинів, які записані на стаканах напівелементів.
Виміряти різницю потенціалів (U) на електродах гальванічних елементів і записати ці значення у протоколі. Порівняти їх з розрахованими значеннями ЕРС. Пояснити, чому вони значно відрізняються у випадку, коли електродами є нікелеві пластини. Згадати, що це пов¢язано з хімічною поляризацією нікелевих електродів внаслідок їх пасивації. Визначити дійсне значення потенціалу нікелевого електрода в елементі 5, використовуючи замірянийта розрахований потенціал цинкового електрода.
Результати вимірів та розрахункові значення занести до таблиці.
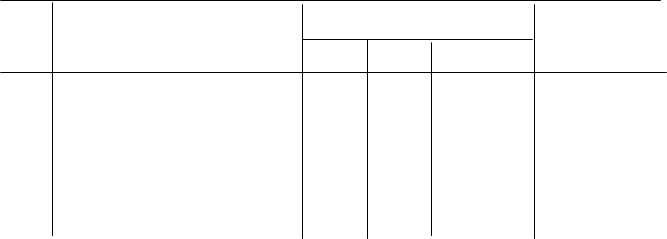 Таблиця
Таблиця
№ п/п Схема гальванічного елемента Розрахункові значення (В) Виміряні
jкат jан ЕРС значення U(В)
По закінчення досліджень схему розімкнути та розібрати, металеві пластини промити та висушити фільтрувальним папером.
Лабораторна робота № 3
ЕЛЕКТРОЛІЗ РОЗЧИНІВ СОЛЕЙ
Мета роботи: вивчення процесів, які відбуваються на електродах у процесі електролізу та визначення маси продуктів електролізу і виходу за струмом.
Дослід 1. Мідніння (електроліз розчину сульфату міді та сульфатної кислоти з розчинним анодом)
І. Характеристики процесу.
Склад електроліту: CuSO4 – 200...250 г/дм3, Н2SO4 – 50...70 г/дм3; аноди – мідні, катод графітовий; густина за струмом (і) – 6...8 А/дм2; швидкість осадження міді 0,2...1,6 мкм/хв.
ІІ. Порядок роботи.
1. Зважити вугільний катод з точністю до 0,01 г і результат записати (m1).
2. Визначити площу частини катоду S, яка занурюється у електроліт (S = hl, де l = pD – довжина кола циліндричного катоду, h - висота змоченої частини катода), виразити її у дм2 (1 дм2 = 100 см2). Обчислити силу струму: І = іS (A).
3. Зібрати прилад для електролізу згідно зі схемою на рис.2.















 1 2
1 2






 3 А 4
3 А 4



 V
V
А К А
6 5 6
 |
7
Рис.2. Схема приладу: 1 – випрямляч; 2 – амперметр; 3 – реостат; 4 – вольтметр (встановлюється 6 В); 5 – катод; 6 – анод; 7 – електролітична ванна з електролітом.
Помістити катод на катодну штангу і через реостат з'єднати з негативним полюсом випрямляча. Аноди помістити на анодні штанги і з'єднати з позитивним полюсом випрямляча. Складену схему запропонувати викладачеві для перевірки. Увімкнути прилад в мережу і негайно виставити реостатом розрахункову силу струму. Зафіксувати час і проводити електроліз на протязі 20...25 хвилин. Після закінчення електролізу схему розімкнути та розібрати, катод промити, висушити
над електроплиткою, зважити (m2) і визначити масу металу, яка виділилася на катоді (mпрак = m2 – m1). Електроліз у цьому випадку зводиться до виділення металу на катоді і поступовому розчиненні аноду.
Під час електролізу необхідно описати дослід, записати процеси на електродах і розрахувати масу металу, яка виділиться на катоді за рівнянням Фарадея:
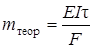 ,
,
де mтеор– маса речовини, яка теоретично повинна виділитися на катоді, г; Е– еквівалентна маса виділеної речовини, г/моль; І– сила струму, А; τ – час електролізу в с або год; F – число Фарадея (96500 Кл/моль, якщо час вимірюється у секундах, або 26,8 А.год/моль, якщо час вимірюється у годинах).
Розрахувати вихід за струмом h згідно з формулою:
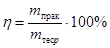 .
.
ІІІ. Завдання. Записати процеси на електродах і розрахувати масу речовини, яка утворюється на аноді за умовами досліду 1, але з нерозчинними анодами.
Дослід 2. Нікелювання. (Електроліз розчину суміші солей та борної кислоти з розчинним нікелевим анодом)
І. Характеристики процесу.
Склад електроліту: NiSO4 – 250...300 г/дм3, Na2SO4 – 60...80 г/дм3, Н3ВО3 – 25...40 г/дм3 (Н3ВО3 додається для підтримування певного значення рН, Na2SO4 – для збільшення електропровідності електроліту); аноди – нікелеві, катод – мідний, густина за струмом (і) – 0,5...2 А/дм2, рН – 5,2...5,8; швидкість осадження нікелю – 0,1...0,4 мкм /хв.
ІІ. Порядок роботи.
1. Зачистити наждачним папером і зважити мідний катод з точністю до 0,01 г; результат записати (m1).
2. Визначити площу частини мідного катода S, яка занурюється в електроліт S = 2hl, де h і l - висота і довжина частини катода, де буде утворюватися покриття, 2 – дві сторони поверхні катода, виразити її у дм2. Обчислити силу струму в амперах (А): І = іS.
3. Далі все, як в п. 3 досліду 1. Пояснити процеси на катоді і анодах.
ІІІ. Завдання. Записати процеси на електродах і розрахувати кількість речовини, яка утворюється на аноді за умовами досліду 2, але з нерозчинними анодами.
Дослід 3. Цинкування. (Електроліз розчину суміші солей з розчинним цинковим анодом)
І. Характеристики процесу.
Склад електроліту: ZnSO4 – 200...300 г/дм3, Al2(SO4)3 – 20...30 г/дм3, Na2SО4 – 25...40 г/дм3. Al2(SО4)3 додається для підтримування певного значення рН, Na2SO4 – для збільшення електропровідності електроліту; аноди – цинкові, катод – залізний, густина за струмом (і) – 1...3 А/дм2, рН – 3,5...4,0; швидкість осадження цинку – 0,2...0,65 мкм /хв.
ІІ. Порядок роботи:
1. Зачистити ретельно наждачним папером і зважити залізний катод з точністю до 0,01 г; результат записати (m1).
2. Визначити площу частини залізного катода S, яка занурюється у електроліт S = 2hl, де h і l - висота і довжина катода, де буде утворюватися покриття, 2 – дві сторони поверхні), виразити її у дм2. Обчислити силу струму в амперах (А): І = і·S .
3. Далі все, як в п. 3 досліду 1. Пояснити процеси на катоді і анодах.
ІІІ. Завдання. Записати процеси на електродах і розрахувати масу речовини, яка утворюється на аноді за умовами досліду 3 але з нерозчинними анодами.
Лабораторна робота № 4
КОРОЗІЯ МЕТАЛІВ
Мета роботи: вивчення причин виникнення мікрогальванопар на поверхні кородуючого металу; визначення стаціонарних потенціалів корозійних процесів.
Дослід 1.Утворення мікрогальванопар на цинку та залізі у кислому середовищі в присутності солі Купруму
1. Шматочок гранульованого цинку помістити в пробірку і долити 2-3 мл розведеної сульфатної кислоти. Спостерігати розчинення цинку і поступове виділення водню за реакцією:
Zn0 + 2H+ ® Zn+2 + H20.
Долити декілька крапель розчину купрум сульфату і спостерігати збільшення швидкості виділення водню внаслідок виникнення мікрогальванічних елементів на поверхні цинку, в яких цинк є анодом, а мідь катодом:
(–) Zn | H2SO4 | H2, (Cu) (+).
Анод окиснюється (розчинюється):
А: Zn0 – 2ē ® Zn+2.
На катоді відбувається воднева деполяризація (процес відновлення):
К: (Cu) 2H+ + 2ē ® 2H0; 2H0 ® H2 .
2. Зробити аналогічний дослід зі шматочком заліза. Записати схему утворено-го корозійного елемента, визначити катод і анод. Записати процеси, які відбува-ються на електродах корозійного гальванічного елемента.
Дослід 2. Корозія внаслідок нерівномірного доступу кисню (диференційної аерації).
На рис.3 зображено поверхню металу, вкритого краплею вологи.
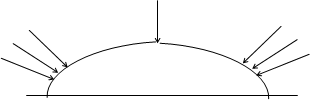 О2
О2
О2 О2
К А К
Рис.3. Схема диференційної аерації
Стальну пластинку ретельно зачистити наждачним папером, промити і висушити фільтрувальним папером. На чисту поверхню нанести 1-2 краплі 3%-го розчину натрій хлориду. У центр цієї краплі додати краплю червоної кров¢яної солі К3[Fe(CN)6], на край краплі – фенолфталеїну.
Внаслідок нерівномірного доступу кисню утворюється корозійний гальванічний елемент
(–)Fe, Fe2+ | H2O, O2(C1) | H2O, O2(C2) | OH–, Fe (+) , C2 > C1, або
(–)Fe, Fe2+ | H2O, O2 | OH–, Fe (+)
Записати катодні а анодні процеси в ньому.
Спостерігати появу синього забарвлення в центрі краплі і рожевого по краях і пояснити ці явища. Записати реакцію, яка підтверджує наявність анодної ділянки
у центрі краплі.
Дослід 3. Активатори корозії
Іони, які руйнують захисні плівки металів і тим самим сприяють корозії, називаються активаторами корозії. У морській воді активаторами є іони хлору.
Помістити в дві пробірки по шматочку або гранулі алюмінію і долити до нього розчин купрум сульфату, трохи підкисленого сульфатною кислотою. В одну з пробірок долити декілька крапель розчину NaCl.
Спостерігати корозію (розчинення) алюмінію в пробірці з NaCl. Пояснити результати досліду, записати схему корозійного гальванічного елемента і реакції на катоді і аноді.
Дослід 4. Визначення стаціонарного потенціалу металу в морській воді
Для визначення стаціонарного потенціалу металу в морській воді зібрати гальванічний елемент, який складається з зразка досліджуваного металу і електрода порівняння (рис.4.)
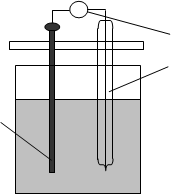 v Рис.4. Схема гальванічного елемента:
v Рис.4. Схема гальванічного елемента:
3 1–досліджуваний зразок; 2–електрод . 2 порівняння; 3 - вольтметр
1
Досліджуваними металами є сталь 3 (j0 = -0,44 В), нержавіюча сталь (j0 = = -0,25 В), алюміній (j0 = -1,68 В), мідь (j0 = +0,34 В), латунь (j0 = -0,44 В). Зразок металу зачистити наждачним папером, протерти фільтрувальним папером і, закріпивши клемою, помістити в склянку з імітатом морської води (3,5%-й розчин NaCl). Потім в склянку помістити хлорсрібний електрод порівняння (j0х.-с = = +0,203 В). Стаціонарний потенціал встановлюється через 1-3 хвилини. В електрохімічне коло підключити вольтметр і заміряти падіння напруги U складеного гальванічного елемента.
Визначити електродні потенціали металів, виходячи з формули U = jк – jа .
Розмістити хімічні символи металів та значення їх стандартних і стаціонарних потенціалів в таблиці в порядку зростання їх величин. Зазначити також значення стандартного водневого електрода і хлорсрібного електрода порівняння.
Дослід 5. Контактна корозія металів.
Розмістити досліджувані в досліді 4 конструкційні матеріали в електрохімічні пари за величиною електродних потенціалів. Занурити пари металів в імітат морської води, закріпити їх клемою і заміряти вольтметром потенціал (падіння напруги) контактної пари. Одержані дані порівняти з потенціалами окремих металів, приведених до контакту. Зробити висновок, до якого з металів, більш чи менш активного, наближається потенціал контактної пари. Скласти схеми утворених гальванічних корозійних елементів, записати електродні реакції.
Зробити загальний висновок по роботі.
Лабораторна робота № 5
