Электрохимическая природа коррозии
Коррозия металла – это постепенное физико-химическое разрушение под действием окружающей среды.
Для электрохимического механизма коррозии металла характерны следующие условия:
условие 1 - наличие разности потенциалов (φ) между отдельными участками поверхности металла (т.е. электрохимическая неоднородность);
условие 2 - наличие электрохимической связи между этими участками;
условие 3 - активное состояние поверхности на анодных участках, где металл растворяется по реакции: nН2О+Ме 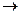 Ме+·nН2О+ē;
Ме+·nН2О+ē;
условие 4 - наличие достаточного количества деполяризатора, в частности кислорода, необходимого для ассимиляции на катодных участках поверхности металла избыточных электролитов: 4ē+О2+2Н2О →4ОН–.
Схема электрохимической коррозии железа следующая:
Поскольку существует электрохимическая неоднородность (неоднородность собственно стали и контактной с бетоном поверхности), то условие 1 выполняется. Выполняются так же условие 2 и условие 4 (бетон электропроводен и кислородопроницаем), то отсутствие коррозии обусловлено невыполнением условия 3.
| Основные условия развития коррозии стальной арматуры в бетоне |
В защитное действие бетона по отношению к арматуре определяется способностью цементного камня пассивировать сталь.
Известно, что в большинстве случаев коррозия металлов происходит по электрохимическому механизму, для осуществления которого необходимы следующие условия:
1) наличие разности потенциалов на поверхности металла;
2) наличие электролитической связи между участками поверхности металла с различными потенциалами,
3) активное состояние поверхности на анодных участках, где осуществляется растворение металла по реакции nH20-f-Me-»-Me+-nH20-e;
4) наличие достаточного количества деполяризатора, в частности кислорода, необходимого для ассимиляции на катодных участках поверхности металла избыточных электронов 4е-+02+2Н20-иЦ0Н).
Первое условие всегда выполняется, поскольку технические металлы имеют неоднородную структуру, неодинаковы и условия контакта поверхности стали с бетоном. Учитывая особенности бетона, представляющего собой капиллярно-пористое тело с активной и гидрофильной внутренней поверхностью, можно полагать, что условия 2 и 4 коррозионного процесса в бетоне имеют место. Бетон почти всегда содержит кроме химически связанной в процессе гидратации цемента физически связанную, т. е. капиллярную и осмотическую воду. Количество физически связанной воды в бетоне, которая в отличие от химически связанной может служить электролитом — проводником зарядов между анодными и катодными участками поверхности стали, зависит как от особенностей бетона, так и от среды и условий взаимодействия ее с конструкцией. При длительном погружении в воду может произойти практически полное насыщение капилляров и пор бетона. В этом случае водосодержание тем больше, чем выше пористость бетона.
При одностороннем контакте без напора, т. е. при капиллярном подсосе воды, степень насыщения бетона обычно ниже, так как высота всасывания воды находится в обратной зависимости от сечения капилляров. Давление насыщенного пара над мениском воды в капиллярах, которые обычно называют макрокапиллярами, практически равно давлению пара над плоской поверхностью, поэтому такие капилляры не всасывают воду и могут заполняться только над напором воды или при конденсации ее, когда в бетоне образуется точка росы.
| Явление пассивности стали в бетоне |
Практическое отсутствие коррозии объясняется пассивностью стали в щелочной среде. Гомашов Н.Д. определяет пассивность, как состояние повышенной коррозионной устойчивости металла, вызванное торможением анодного процесса.
Наступление пассивности характеризуется обычно резким облагораживанием электродного потенциала металла.
В соответствии с диаграммой Пурбэ, при рН=12-13 и имеющих место потенциалах наблюдается явление пассивности (при широкой гамме потенциалов)
Снижение скорости растворения металла настолько велико, что коррозия практически прекращается.
Граница пассивирующего действия Са(ОН) проходит около рН=12 при свободном и рН=11,5 при ограниченном доступе воздуха.
Если есть активирующие ионы (СI–), то явление пассивности не поступает и при больших рН. Основная информация – по ходу анодных поляризационных кривых.
Существует две теории пассивности.
1. Адсорбционный механизм пассивности: связывается наступление пассивного состояния с адсорбцией кислорода (или других атомов), изменяющей или химические свойства поверхности, вследствие насыщения свободных валентностей металла посторонними атомами, или строение двойного электрического слоя, в результате чего затрудняется протекание электрохимической реакции растворения металла.
2. Пассивность связывается с образованием на поверхности металла фазовой защитной пленки, представляющей собой кислородное соединение металла.
Эти теории взаимно заполняются так, по мере того, как адсорбционная пленка, утолщаясь, переходит в фазовую, анодный процесс испытывает дополнительное торможение при прохождении ионов непосредственно через защитную пленку.
| Влияние бетона на коррозионные процессы арматуры |
| Карбонизация бетона |
Следует учитывать, что при карбонизации электропроводность снижается в 3-4 раза.
Процесс карбонизации включает:
– диффузию СО2 в порах и капиллярах бетона, заполненных воздухом;
– растворение СО2 в жидкой фазе с образованием угольной кислоты: СО2+Н2О 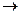 Н2СО3
Н2СО3
– взаимодействие кислоты с образование карбоната и бикарбоната кальция
Са(ОН)2+ Н2СО3→СаСО3+2Н2О
СаСО3+Н2СО3→Са(НСО3)2
– кристаллизация карбоната кальция.
Общая формула для расчета кинетики карбонизации:
Х= 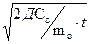 или Х=А
или Х=А 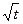
Х – толщина нейтрализационного слоя;
Д – эффективный коэффициент диффузии, характеризующий проницаемость;
m0 – способность бетона поглощать углекислоту, зависящий от расхода цемента, степени гидратации, структуры пор;
С0 – концентрация СО2
t– время
При известных сроках эксплуатации t, и глубине нейтрализации Х1 легко рассчитать Х2 в любой другой срок:
Х2=Х1 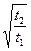 ;
;
а если лишняя концентрация газа, то
Х2=Х1 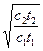 ;
;
