Опыт 3: Углекислый газ, угольная кислота и ее соли.
Лабораторная работа №6
Углерод, кремний.
Опыт 1: Активированный уголь.
В стакан поместили несколько кусочков древесного угля и залили водой. Нагревали до тех пор, пока уголь не утонул. Уголь высушили на фильтровальной бумаге и поместили в керамический тигель. Закрыли крышкой и прокаливали в течении нескольких минут при 500°С. Охладили в эксикаторе, поместили уголь в пробирку, залили слабым раствором фуксина и взболтали. Раствор обесцветился. Это обусловлено тем, что древесный уголь стал активированным и добавленный фуксин адсорбировался на развитой внутренней поверхности пор угля.
Опыт 2: Оксид углерода (II) (под тягой).
Оксид углерода получили нагреванием в пробирке с газоотводной трубкой щавелевой кислоты с концентрированной серной кислотой и пропустили через аммиачный раствор нитрата серебра, светло-розовый сернокислый раствор перманганата калия (добавили каплю раствора нитрата серебра - катализатор) и светло-оранжевый сернокислый раствор дихромата калия (добавили каплю раствора нитрата ртути (II) – катализатор). В первом случае выпал черный осадок, во втором – раствор обесцветился, в третьем – окраска раствора изменилась на зелёную.
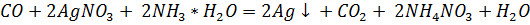
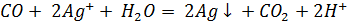
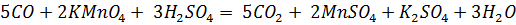
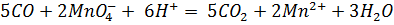
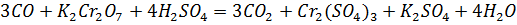
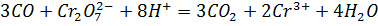
Опыт 3: Углекислый газ, угольная кислота и ее соли.
а) Универсальным индикатором измерили рН дистиллированной воды. рН = 6. Это говорит о том, что в ней растворен углекислый газ.
б) Из аппарата Киппа очищенным и осушенным углекислым газом (пропусканием углекислого газа через дистиллированную воду, пропусканием через концентрированную серную кислоту) наполнили три большие банки (нужно в банку отпустить лучинку, если пламя гаснет в верхней части банки, значит она полная). На слабое пламя горелки вылили содержимое одной из них. Пламя горелки затухает. Во вторую банку щипцами внесли горящий магний. Он продолжал гореть, и при этом сильно коптил. В третью внесли ложечку с горящим красным фосфором. Горение прекратилось. Таким образом, углекислый газ поддерживает горение магния, а фосфора – нет.
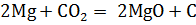
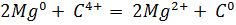
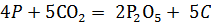
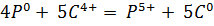
в) В 0,1 н раствор щелочи добавили каплю раствора фенолфталеина и пропустили ток чистого углекислого газа из аппарата Киппа до исчезновения окраски. Раствор прокипятили. Окраска снова появилась.
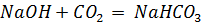
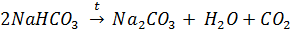
г) Теоретически оценили (на уровне - < или > 7) рН водного раствора питьевой соды. Константы диссоциации для угольной кислоты:
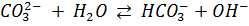 ; Ka1=4,5*10-7
; Ka1=4,5*10-7
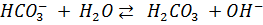 ; Ka2=5*10-11
; Ka2=5*10-11
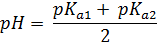
Константы диссоциации для децинормального (0,1M)раствора питьевой соды в воде получаем:
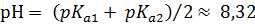
д) Растворы хлоридов магния и алюминия обработали раствором соды. При взаимодействии с раствором хлорида магния выпадает белый осадок, при взаимодействии с хлоридом алюминия – студенистый белый осадок.
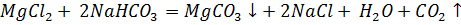
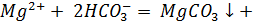
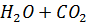
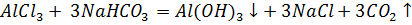
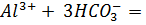
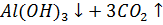
е) Составили проиллюстрированную уравнениями реакций методику химической очистки водного раствора карбоната натрия от примесей гидрокарбоната, сульфита и сульфата.
1)Прокипятить раствор. При этом: 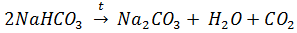
2)Произвести окисление перекисью водорода: 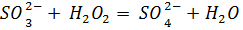
3)Титрованием установить точную концентрацию сульфата в растворе, рассчитать количество 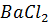 , необходимое для его связывания, и прибавить к раствору, тщательно перемешивая:
, необходимое для его связывания, и прибавить к раствору, тщательно перемешивая: 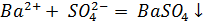
Отфильтровать полученный раствор.
Опыт 4: Кремний.
Тщательно смешали равные навески порошков магния и кремнезема и нагрели в пробирке до начала реакции. Реакционную массу охладили и обработали избытком соляной кислоты. Осадок отфильтровали, промыли дистиллированной водой и высушили. Взвесили и определили выход кремния по кремнезему. Часть полученного кремния испытали на растворимость в кислотах и щелочах.
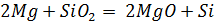
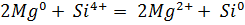
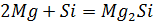
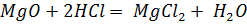
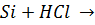 реакция не идет
реакция не идет
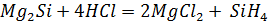
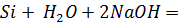
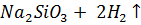
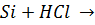 реакция не идет
реакция не идет
