Раздел Аналитическая химия
Лабораторная работа №7
«Определение жесткости воды»
Цель работы: с помощью метода комплексонометрии определить жесткость воды в различных округах г. Курска.
Задачи: 1) образовательная: с помощью объемного метода анализа определить катионы кальция и магния в воде.
2) развивающая: развивать в процессе формирования понятий диалектического подхода и специфических способов познания;
3) воспитательная: формирование химической картины природы, необходимых норм отношения к окружающей действительности.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ.
Жесткость — один из технологических показателей, принятых для характеристики состава и качества природных вод.
Жесткой называют воду с повышенным содержанием ионов Са2+ и Mg2+. Сумма концентрации ионов Са2+ и Mg2+ является количественной мерой жесткости воды: 
Ж = ССа2+ + СMg2+
Измеряют жесткость числом миллимолей ионов жесткости (Ca2+ и Mg2+ в 1 кг воды (ммоль/кг). В связи с тем, что плотность воды близка к единице, жесткость можно измерять в ммоль/дм3 или ммоль/л. Различают жесткость воды общую Жо, карбонатную Жк и некарбонатную Жнк.
Комплексонометрическое определение общей жесткости воды производится с помощью реактива, который имеет целый ряд названий: трилон Б, комплексон III, хелатон 3 и др. По химической номенклатуре – это динатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА)
(HOОCH2)2N – CH2 – CH2 – N(CH2COONa)2·H2O
Трилон Б образует очень устойчивые комплексы с большинством катионов: Ca2+; Mg2+; Co2+; Cu2+; Ni2+; Zn2+; Fe2+ и др. При рН=10 трилон Б связывает катионы кальция и магния. В качестве индикатора применяется хромоген черный, который в присутствии этих ионов образует комплексы [Ca Ind]- и [Mg Ind]- вино-красного цвета. В результате титрования раствора, содержащего кальций, магний и индикатор, раствором комплексона III, ионы жесткости связываются в более прочный комплекс с комплексоном и в точке эквивалентности анионы индикатора освобождаются и придают раствору синюю окраску.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.
ОПРЕДЕЛЕНИЕ ОБЩЕЙ ЖЕСТКОСТИ ВОДЫ
Отберите мерным цилиндром 100 мл воды и перенесите ее в коническую колбу. Добавьте к исследуемой воде 5 мл аммонийной буферной смеси и несколько кристаллов хромогена до получения вино-красного раствора.
Приготовленную пробу оттитруйте 0,05н раствором трилона Б до перехода вино-красной окраски индикатора в синюю. Результат титрования запишите.
Повторите титрование еще раз. Если результаты двух титрований совпадут (∆V<0,1 мл), рассчитайте общую жесткость воды. В противном случае оттитруйте еще одну пробу воды. Найди средний объем раствора, израсходованный на титрование воды. Рассчитываем общую жесткость воды позакону эквивалентов (ммоль/л):
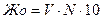
где V— объем раствора трилона Б; N - молярная концентрация эквивалентов раствора трилона Б , 10 - коэффициент перевода моль/л в ммоль/л.
ОПРЕДЕЛЕНИЕ КАРБОНАТНОЙ И НЕКАРБОНАТНОЙ ЖЕСТКОСТИ ВОДЫ
Отберите мерным цилиндром 100 мл воды и перенесите ее в коническую колбу. Добавьте к исследуемой воде несколько капель метилового оранжевого, чтобы окраска раствора в колбе по интенсивности была близкой к окраске контрольного раствора с этикеткой «до титрования».
Приготовленную пробу оттитруйте раствором соляной кислоты до перехода желтой окраски индикатора в оранжевую (но не розовую, см. контрольные растворы.) Результат титрования запишите.
Повторите титрование еще раз. Если результаты двух титрований совпадут (∆V<0,1 мл), рассчитайте карбонатную жесткость воды. В противном случае оттитруйте еще одну пробу воды. Найди средний объем раствора соляной кислоты, израсходованный на титрование воды. Рассчитываем карбонатную жесткость воды позакону эквивалентов (ммоль/л):
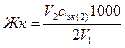
где V1— объем анализируемой воды, мл; 2 - объем раствора НСl, с - молярная концентрация эквивалентов раствора НС1, моль/л; 1000 - коэффициент перевода моль/л в ммоль/л.
Некарбонатную жесткость воды Жнк находят по разности
Жнк = Жо-Жк
Результаты опыта сведите в таблицу:
| Объем раствора НСl V2 | Молярная концент-рация эквивалентов раствора HС1 cэк(2) | Объем исследуемой пробы V1 | Жесткость воды | |
| Жк | Жнк | |||
Контрольные задания:
6. На чем основан метод комплексометрии?
7. Какой технологический показатель качества воды наливают жесткостью?
8. Какие катионы называют ионами жесткости?
9. Как рассчитать карбонатную жесткость воды?
Основная литература:
1. Коровин, Н.В. Общая химия: учеб. / Н.В.Коровин. – М.: Высшая школа, 2000. – С. 500-510
2. Коровин, Н.В. Лабораторные работы по химии / Н.В.Коровин, Э.М. Мингулина, Н.Г. Рыжова; Под ред. Н.В Коровина. – М.: Высшая школа, 2001. – С.204-210.
Дополнительная литература:
1. Ахметов Н.С. Общая и неорганическая химия. М.: Высшая школа.
1988.с.139-154
2. Глинка Н.Л. Общая химия. Л. : Химия, 1983.
3. Крешков А.П. Основы аналитической химии (качественный и количественный анализ).М., ГХИ, 1961.с. 235-294
4. Лучинский Г. П. Курс химии. М.: Высшая школа,1985.с. 54-60
5. Фролов В.В. Химия. М. Высшая школа, 1986. с. 305-307
6. Зайцев О. С. Задачи и вопросы по химии. М.: Химия, 1985.
7. Романцева Л. М., Лещинская З. Л., Суханова В.А. Сборник задач и упражнений по общей химии. М.: Высшая школа,1980.
Лабораторная работа №8.
«Колориметрическое определение меди в растворе»
Цель работы:изучение колориметрического метода анализа.
Задачи: 1) образовательная: изучить некоторые виды абсорбционного анализа на практике;
2) развивающая: развивать в процессе формирования понятий диалектического подхода и специфических способов познания;
3) воспитательная: формирование химической картины природы, необходимых норм отношения к окружающей действительности.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ.
Инструментальные методы анализа обладают многими достоинствами: быстротой анализа, высокой чувствительностью, возможностью одновременного определения нескольких компонентов, автоматизации и использования копьютеров для обработки результатов анализа.
Колориметрия — один из наиболее простых методов абсорбционного анализа, основанный на измерении поглощения света окрашенными растворами.
Абсорбционный анализ подразделяют на спектрофотометрический и колориметрический. Спектрофотометрия учитывает поглощение анализируемым веществом света с определенной длиной волны. Такие измерения производят с помощью специальных приборов — спектрофотометров. В колориметрии используют видимый спектр.Из всех оптических методов колориметрический анализ имеет в настоящее время наиболее важное значение для физических и химических исследований. С помощью этого метода изучают содержание большинства ионов в различных объектах, так как он отличается высокой чувствительностью. При этом определяемый компонент переводят в окрашенное соединение и по интенсивности окраски раствора судят о количестве компонента.
Чтобы определить количественное содержание элемента в исследуемом растворе, сравнивают его окраску с окраской «стандартного» раствора, концентрация определяемого элемента в котором точно известна. ^
Зависимость между интенсивностью окраски раствора и содержанием в нем окрашенного вещества подчиняется закону Бугера – Ламберта - Бера и выражается уравнением:
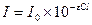 ,
,
где I - интенсивность потока света, прошедшего через раствор; I0 -интенсивность потока света, падающего на раствор; ε - коэффициент поглощения света - постоянная величина, зависящая от природы растворенного вещества (молярный коэффициент поглощения); С - молярная концентрация окрашенного вещества в растворе; l - толщина слоя светопоглощающего раствора
Физический смысл закона Бугера – Ламберта - Бера состоит в следующем. Растворы одного и того же окрашенного вещества при одинаковой его концентрации и толщине слоя, также при прочих равных условиях поглощают одну и ту же долю падающего на них света. То есть светопоглощение таких растворов одинаково.
Если прологарифмировать приведенное выше уравнение и изменить знаки на обратные, то оно принимает следующий вид:
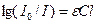
Величина lg(I0/I) является важнейшей характеристикой окрашенного раствора, ее называют оптической плотностью раствора и обозначают буквой D:
D = lg(I0/I) = εCl
Следовательно, оптическая плотность раствора прямо пропорциональна концентрации окрашенного вещества и толщине слоя раствора.
Из этого вытекает вывод, очень важный для колориметрического анализа. Если сравнивают два раствора с различной концентрацией какого-нибудь окрашенного вещества, то одинаковая интенсивность окраски этих растворов достигается при толщине их слоев, обратно пропорциональной концентрациям.
Фотоэлектроколориметр, или фотоколориметр, предназначен для определения оптической плотности окрашенных растворов. Измеряя оптическую плотность нескольких растворов с разной, но известной концентрацией окрашенного вещества, строят калибровочную кривую зависимости оптической плотности от концентрации раствора. По калибровочной кривой можно определить концентрацию раствора, измерив его оптическую плотность.
