Классификация комплексных соединений. I и II законы термодинамики
I и II законы термодинамики
I закон термодинамики
Количество тепла, сообщенное системе, идет на приращение внутренней энергии системы и на совершение системой работы над внешними телами.
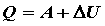
II закон термодинамики
Все самопроизвольные процессы в природе идут с увеличением энтропии
∆G<0 – самопроизвольный процесс
∆G=0 – состояние равновесия
Скорость реакции
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства.
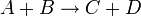
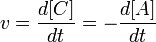
Порядок реакции
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции.
Реакция нулевого порядка
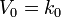
Реакция первого порядка
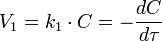
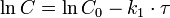
Константа скорости реакции 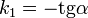
Реакция второго порядка
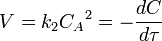
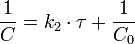
Константа скорости реакции 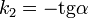
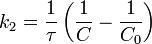
Константа скорости
Константа скорости реакции - является коэффициентом пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или их произведение равно единице. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
Энергия активации
Энергия, которую надо сообщить молекулам (частицам) реагирующих веществ, чтобы превратить их в активные, называется энергией активации.
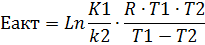
Энергетические уровни
Энергетический уровень — собственные значения энергии квантовых систем, то есть систем, состоящих из микрочастиц (электронов, протонов и других элементарных частиц) и подчиняющихся законам квантовой механики
На первом энергетическом уровне (n = 1) орбитальное квантовое число l принимает единственное значение l = (n - 1) = 0. Форма обитали - сферическая; на первом энергетическом только один подуровень - 1s. Для второго энергетического уровня (n = 2) орбитальное квантовое число может принимать два значения: l = 0, s- орбиталь - сфера большего размера, чем на первом энергетическом уровне; l = 1, p- орбиталь - гантель. Таким образом, на втором энергетическом уровне имеются два подуровня - 2s и 2p. Для третьего энергетического уровня (n = 3) орбитальное квантовое число l принимает три значения: l = 0, s- орбиталь - сфера большего размера, чем на втором энергетическом уровне; l = 1, p- орбиталь - гантель большего размера, чем на втором энергетическом уровне; l = 2, d- орбиталь сложной формы.
Таким образом, на третьем энергетическом уровне могут быть три энергетических подуровня - 3s, 3p и 3d.
S,p,d – элементы
Электронные орбитали бывают разных размеров, располагаются на различных расстояниях от ядра и притягиваются к ядру с различными силами. Электроны с орбиталями, близкими по размеру и энергии, образуют электронные слои. Электронные слои называют также энергетическими или электронными уровнями. Начиная от ядра электронные уровни нумеруются следующим образом: 1, 2, 3, 4, 5, 6, 7 или K, L, M, N, O, P, Q.
Целое число n, обозначающее номер уровня, называется главным квантовым числом и характеризует энергию электронов, занимающих данный энергетический уровень. Число заполненных электронами энергетических уровней в атоме численно равно номеру периода периодической системы, в котором данный атом находится. Наибольшее число электронов на данном энергетическом уровне равно N= 2n2, где N- число электронов, n- номер уровня или главное квантовое число. Согласно этой формуле максимальное число электронов на первом энергетическим уровне равно 2, на втором- 8, на третьем- 18, на четвертом- 32. Во внешнем, последнем электронном слое атома не бывает больше 8 электронов.
Строение электронных уровней. Квантовые числа. Принцип Паули.
Электронные уровни, начиная с n³2, разделяются на подуровни (подслои). Подуровни отличаются друг от друга энергией связи с ядром. Количество подуровней равно значению главного квантового числа, но не превышает четырех, т.е. первый уровень имеет один подуровень, второй имеет два подуровня, третий- три, четвертый и все остальные- четыре подуровня. Каждый подуровень состоит из орбиталей определенного вида, которым соответсвуют определенные значения орбитального квантового числа l. Подуровни со значениями l равными 0, 1, 2, 3 называются соответственно s-, p-, d-, f- подуровнями. Число орбиталей на каждом подуровне равно 2l+1, столько значений может принимать магнитное квантовое число m, определяющее пространственную ориентацию орбиталей. В каждом энергетическом уровне наиболее близко к ядру располагается s- подуровень, состоящий из одной s- орбитали. Далее следует р- подуровень, состоящий из трех р- орбиталей. Следующим подуровнем является d- подуровень, вмещающий пять d- орбиталей. Четвертым является f- подуровень, образованный семью f- орбиталями. Каждому квантовому числу n соответствует общее число орбиталей, равное n2, то есть каждый электронный уровень состоит из n2 орбиталей. Согласно принципу Паули, на каждой орбитали может находиться не более двух электронов. Это связано с тем, что двигаясь около ядра электрон одновременно вращается вокруг своей оси. Это движение называется спиновым движением или спином и характеризуется спиновым квантовым числом ms. Если два электрона имеют одинаковые направления спинового вращения, то говорят, что это электроны с параллельными спинами. В случае же, когда спины электронов противоположны, то это электроны с антипараллельными спинами. Электроны с антипараллельными спинами создают вокруг себя магнитное поле с противоположно направленными силовыми линиями, что способствует их взаимному притяжению. Поэтому на одной орбитали могут находиться два электрона, но только в том случае, если у них противоположные спины. Такие электроны называются спаренными. Таким образом, у спаренных электронов одинаковый набор чисел n, m и l, но различные значения ms. Согласно этому, принцип Паули может быть сформулирован следующим образом: в атоме не может быть двух электронов, характеризующихся одинаковым набором квантовых чисел. Из этого следует, что каждая атомная орбиталь может быть занята не более чем двумя электронами, причем их спиновые квантовые числа должны быть различны, что символически обозначается ¯
Как видно, для характеристики электрона в атоме необходимо знать значения его квантовых чисел, то есть номер энергетического уровня (главное квантовое число n), тип орбитали (орбитальное квантовое число l), пространственное расположение орбиталей (магнитное квантовое число m) и проекцию его спина (спиновое квантовое число ms)
Электроотрицательность
Эле́ктроотрица́тельность - фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары

Ионная связь
Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностью (>1,5 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.Это притяжение ионов как разноименно заряженных тел.
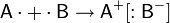
Ковалентно-полярная связь
Полярная (несимметричная) ковалентная связь – связь между атомами с различной электроотрицательностью (2 > Δχ > 0,5) и несимметричным распределением общей электронной пары.
Электронная плотность такой связи смещена в сторону более электроотрицательного атома, что приводит к появлению на нем частичного отрицательного заряда δ– (дельта минус), а на менее электроотрицательном атоме – частичного положительного заряда δ+ (дельта плюс):
Cδ+— Clδ–, Cδ+— Oδ–, Cδ+— Nδ–, Oδ–— Hδ+, Cδ–— Mgδ+
Направление смещения электронов обозначается также стрелкой:
C → Cl, C → О, C → N, О ← Н, C ← Mg
Классификация комплексных соединений
Существует несколько классификаций комплексных соединений в основу которых положены различные принципы.
По заряду комплекса
1) Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др.).
[(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II)
[Co(NH3)6]Cl2 — хлорид гексаамминкобальта(II)
2) Анионные комплексы: в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы.
K2[BeF4] — тетрафторобериллат(II) калия
Li[AlH4] — тетрагидридоалюминат(III) лития
K3[Fe(CN)6] — гексацианоферрат(III) калия
3) Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а также при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул.
[Ni(CO)4] — тетракарбонилникель
[Pt(NH3)2Cl2] — дихлородиамминплатина(II)
[править]
По числу мест, занимаемых лигандами в координационной сфере
Структура комплексного иона, образованного катионом металла и анионом ЭДТА
1) Монодентатные лиганды. Такие лиганды бывают нейтральными (молекулы Н2О, NH3, CO, NO и др.) и заряженными (ионы CN−, F−, Cl−, OH−, SCN−, S2O32− и др.).
2) Бидентатные лиганды. Примерами служат лиганды: ион аминоуксусной кислоты H2N — CH2 — COO−, оксалатный ион −O — CO — CO — O−, карбонат-ион СО32−, сульфат-ион SO42−.
3) Полидентатные лиганды. Например, комплексоны — органические лиганды, содержащие в своём составе несколько групп −С≡N или −COOH (этилендиаминтетрауксусная кислота — ЭДТА). Циклические комплексы, образуемые некоторыми полидентатными лигандами, относят к хелатным (гемоглобин и др.).
По природе лиганда
1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 и др.
2) Аквакомплексы — в которых лигандом выступает вода: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др.
3) Карбонилы — комплексные соединения, в которых лигандами являются молекулы оксида углерода(II): [Fe(CO)5], [Ni(CO)4].
4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. К ним относятся комплексные соли: K2[PtCl4], комплексные кислоты: H2[CoCl4], H2[SiF6].
5) Гидроксокомплексы — комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
