Глава 5 Нитроорганические соединения
Фрау Шенбейн, утратившая фартук в результате новаторских опытов мужа, — не первая в истории жертва взрыва созданных человеком взрывчатых веществ и, конечно, не последняя. Если химическая реакция протекает очень-очень быстро, она может обладать поистине страшной разрушительной силой. Целлюлоза — лишь одна из многих молекул, измененных человеком для получения взрывчатки. Некоторые из полученных химических соединений принесли человечеству огромную пользу, другие, напротив, причинили ему тяжкий урон. Но, как бы то ни было, эти соединения оказали на наш мир существенное влияние и изменили его лицо.
Структура взрывчатых веществ весьма разнообразна, однако в большинстве случаев молекулы этих веществ содержат нитрогруппы. Эта маленькая группа атомов, состоящая из одного атома азота и двух атомов кислорода (NO2), присоединенная в правильной позиции, изменила характер современной войны, определила судьбу целых народов, в буквальном смысле позволила человеку двигать горы.
Порох
Порох (черный порох) — первая взрывоопасная смесь, придуманная человеком, — уже в древности использовался в Китае, Индии и в Аравии. В древних китайских текстах упоминается “огненное зелье”. Состав пороха был впервые описан только в начале 1000-х годов, но и тогда точная пропорция нитратной соли, серы и углерода не была известна. Нитратная соль (селитра, “китайский снег”, “китайская соль”) представляет собой нитрат калия, химическая формула которого такова: KNO3. Углерод для пороха брали в виде древесного угля, что и объясняло черный цвет порошка.
Сначала порох использовали для салютов и фейерверков, однако к середине XI века военные научились пускать огненные стрелы. В 1067 году производство серы и селитры было взято китайским правительством под контроль.
Мы точно не знаем, когда порох прибыл в Европу. Францисканский монах Роджер Бэкон, родившийся в Англии и обучавшийся в университетах Оксфорда и Парижа, упомянул о порохе около 1260 года, за несколько лет до того, как Марко Поло вернулся в Венецию с рассказами о китайском “огненном зелье”. Бэкон был ученым и экспериментатором. Он занимался вопросами, которые сейчас мы отнесли бы к области астрономии, химии и физики. Он знал арабский язык, так что, возможно, читал и о порохе. Бэкон мог знать о разрушительной силе пороха, поскольку дал его описание в виде анаграммы, которую следовало расшифровать: семь частей селитры, пять — древесного угля, пять частей серы. Загадка оставалась нераскрытой на протяжении 650 лет, пока ее не разгадал один английский полковник[8].
Современные типы пороха несколько различаются по составу, однако все содержат значительно больше селитры, чем указал Бэкон. Химическую реакцию взрыва пороха можно записать следующим образом:
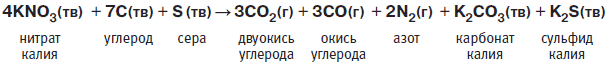
Из этой химической реакции можно узнать соотношение реагирующих веществ и образующихся продуктов. Буквы “тв” в скобках говорят о том, что данное вещество твердое, а буква “г” указывает на то, что это — газ. Из уравнения видно, что все реагирующие вещества твердые, но в результате реакции образуется восемь газообразных молекул: три молекулы двуокиси углерода, три — окиси углерода и две — азота. Именно горячие расширяющиеся газы, образующиеся при быстром горении пороха, толкают пушечное ядро или пулю. Образующиеся твердые карбонат и сульфид калия распыляются в виде мельчайших частичек и являются причиной появления плотного дыма, сопровождающего взрыв пороха.
Первое огнестрельное оружие, появившееся между 1300 и 1325 годом, представляло собой железную трубку, заваренную с одного конца. Ее наполняли порохом, который поджигали раскаленной проволокой. По мере развития оружия — фитильный, колесцовый, кремневый замки — возникала потребность в порохе с разной скоростью возгорания. Порох для пистолетов должен был гореть быстро, ружейный — медленнее, для пушек и ракет — еще медленнее. Смесь воды и спирта использовали для получения прессованного пороха, который можно было измельчить и разделить на тонкую, среднюю и грубую фракцию. Чем мельче порошок, тем быстрее горение. Так стало возможным получать порох для различных нужд. Вместо воды для изготовления пороха часто брали мочу рабочих пороховых заводов, поскольку считалось, что моча людей, пьющих много вина, способствует получению наиболее мощного пороха. Для получения пороха высшего качества также подходила моча священника, а лучше епископа.
Химия взрыва
Движущей силой взрыва является образование газов и их быстрое расширение под действием реакционного тепла. Газы занимают гораздо больший объем, чем аналогичное количество твердого вещества или жидкости. Разрушительное действие взрыва связано с ударной волной, вызванной очень быстрым изменением объема вещества при образовании газов. Ударная волна, образующаяся при взрыве пороха, распространяется со скоростью несколько сотен метров в секунду, однако в случае более мощной взрывчатки (такой как тринитротолуол или нитроглицерин) скорость ударной волны может достигать шести тысяч метров в секунду.
При любом взрыве выделяется большое количество тепла. Реакции, сопровождающиеся выделением тепла, называют экзотермическими. Большое количество тепла способствует активному расширению газов: чем выше температура, тем больше объем газовой смеси. Выделение тепла связано с различием между молекулами, расположенными в двух частях уравнения реакции. Образующиеся молекулы (находящиеся в правой части уравнения) обладают меньшей энергией, запасенной в их химических связях, чем исходные молекулы (находящиеся слева). Образующиеся вещества более устойчивы. В частности, в реакциях взрыва нитросоединений образуется чрезвычайно устойчивая молекула азота N2. Стабильность этой молекулы связана с прочностью тройной связи, соединяющей два атома азота.
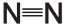
Структура молекулы азота
Прочность тройной связи означает, что для ее разрыва требуется много энергии. Напротив, при образовании тройной связи высвобождается большое количество энергии, что и происходит при взрыве.
Кроме образования газов и выделения тепла, третьим важным свойством реакций взрыва является их высокая скорость. Если бы реакция протекала медленно, выделяющееся тепло успевало бы рассеяться, а газ диффундировал в окружающую среду, не оказывая значительного давления и не вызывая разрушительной ударной волны. Требующийся для реакции кислород должен содержаться в самой взрывчатке. Атмосферный кислород нельзя использовать по той причине, что он не может поступать в реакцию достаточно быстро. Именно по этой причине нитросоединения, в которых азот и кислород соединены между собой, часто бывают взрывоопасными, а другие соединения, содержащие не связанные между собой азот и кислород, таковыми не являются.
Сказанное можно проиллюстрировать на примере изомеров. Как мы уже знаем, изомеры — это вещества с одинаковой химической формулой, но разной структурой. Лоро-нитротолуол и пара-аминобензойная кислота с одинаковой химической формулой C7H7NO2 имеют по семь атомов углерода, семь атомов водорода, одному атому азота и два атома кислорода, но атомы в этих двух молекулах расположены в разной последовательности.
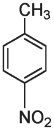
n-нитротолуол
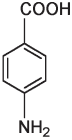
n-аминобензойная кислота
Пора- или n-нитротолуол (приставка пора означает, что группы CH3 и NO3 располагаются в противоположных позициях в кольце) может взрываться, тогда как n-аминобензойная кислота ничуть не взрывоопасна. Возможно, вы даже втирали это вещество себе в кожу летом: n-аминобензойная кислота, или ПАБА, является активным ингредиентом многих солнцезащитных кремов. Такие вещества, как ПАБА, поглощают ультрафиолетовый свет как раз с такой длиной волны, которая является наиболее опасной для клеток кожи. Поглощение света с определенной длиной волны связано с присутствием в молекуле чередующихся одинарных и двойных связей, а также атомов кислорода и азота. Изменение числа связей или атомов в таких структурах изменяет длину волны поглощаемого света. Существуют и другие вещества, поглощающие свет со специфической длиной волны, которые можно использовать в составе кремов от солнца, — при условии, что они не очень быстро смываются водой, нетоксичны, не вызывают аллергии, не имеют неприятного вкуса или запаха и не разлагаются на солнце.
Взрывоопасность соединений, содержащих нитрогруппы, зависит от количества этих групп. Нитротолуол имеет только одну нитрогруппу. Дальнейшее нитрование может привести к добавлению еще одной или двух нитрогрупп с образованием соответственно ди— или тринитротолуола. Хотя нитротолуол и динитротолуол могут взрываться, они не вызывают взрыва такой силы, как тринитротолуол (ТНТ, тротил).
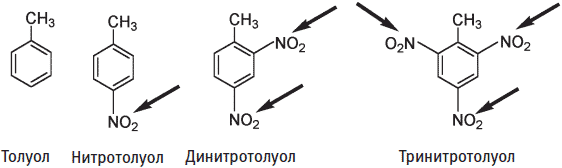
Нитрогруппы показаны стрелками
Новые взрывчатые вещества начали появляться в XIX веке, когда химики занялись изучением взаимодействия азотной кислоты с органическими соединениями. Спустя несколько лет после того, как Фридрих Шенбейн испортил фартук своей жены, итальянский химик Асканьо Собреро, работавший в Турине, синтезировал новое взрывчатое нитросоединение. Собреро изучал влияние азотной кислоты на некоторые органические вещества. Он поместил глицерин, который легко выделить из животного жира, в охлажденную смесь серной и азотной кислот, а затем вылил полученную смесь в воду. Образовался слой масляной жидкости, которую теперь называют нитроглицерином. Далее он выполнил традиционную в те времена и немыслимую сегодня манипуляцию: попробовал новое вещество на вкус и записал, что “следовое количество вещества, помещенное на язык, но не проглоченное, вызывает множественные пульсации, сильную головную боль и слабость в конечностях”.
Позднее изучение причин сильной головной боли у рабочих, занятых в производстве взрывчатых веществ, показало, что головная боль связана с расширением кровеносных сосудов под действием нитроглицерина. В результате нитроглицерин стали применять как лекарство от стенокардии.
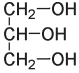
Глицерин
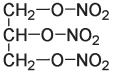
Нитроглицерин
Расширение суженных сосудов, снабжающих кровью сердечную мышцу, обеспечивает нормальную подачу крови и снимает боль. Теперь известно, что в организме от нитроглицерина отщепляется молекула окиси азота NO, которая и вызывает расширение сосудов. Исследования действия окиси азота привели к созданию лекарства от импотенции, виагры, действие которого также основано на сосудорасширяющих свойствах NO.
Кроме того, в организме окись азота участвует в поддержании кровяного давления, передаче межклеточных сигналов, формировании долгосрочной памяти, а также в пищеварении. На основании этих исследований были созданы лекарства для нормализации кровяного давления у новорожденных и для лечения больных после перенесенного инсульта. В 1998 году Нобелевскую премию в области медицины получили Роберт Ферчготт, Луис Игнарро и Ферид Мурад за открытие роли окиси азота в организме. По иронии судьбы, сам Альфред Нобель, сделавший состояние на производстве динамита из нитроглицерина, что позволило ему учредить Нобелевскую премию, отказался лечиться нитроглицерином. Он умер от стенокардии, так и не поверив, что нитроглицерин способен врачевать. Он считал, что это вещество способно лишь вызвать головную боль.
Нитроглицерин — очень неустойчивая молекула. Он взрывается при нагревании или сильном ударе.
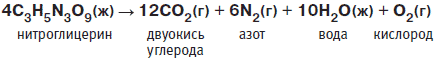
В результате взрыва образуются облака быстро расширяющихся газов и большое количество тепла. В отличие от пороха, при взрыве которого давление в шесть тысяч атмосфер возникает за тысячную долю секунды, при взрыве эквивалентного количества нитроглицерина за миллионную долю секунды создается давление в двести семьдесят тысяч атмосфер. Порох сравнительно безопасен в обращении, а вот нитроглицерин ведет себя чрезвычайно непредсказуемо. Он способен взрываться спонтанно при встряхивании или нагревании. Вот почему людям пришлось найти надежный и безопасный способ обращения с этим строптивым веществом, а также способ его детонации.
Динамит Нобеля
Альфреду Бернхарду Нобелю, родившемуся в 1833 году в Стокгольме, пришла идея использовать для взрыва нитроглицерина вместо фитиля (от которого нитроглицерин просто медленно горит) небольшое количество пороха, взрыв которого вызывает более сильный взрыв нитроглицерина. Это была великолепная идея. Она сработала, и данный принцип до сих пор используется во многих взрывных устройствах, применяемых в горном деле и строительстве. Нобель решил проблему осуществления взрыва, но ему оставалось еще решить проблему предотвращения нежелательного взрыва.
Семья Нобелей владела заводом по производству взрывчатки, на котором в 1864 году началось производство нитроглицерина для коммерческих нужд, в частности, для прокладки шахт и туннелей. В сентябре того же года в одной из заводских лабораторий произошел взрыв. Погибли пять человек, в том числе Эмиль Нобель, младший брат Альфреда. Причины случившегося так и не были установлены, но городские власти возложили вину на нитроглицерин. Однако Нобель не испугался и построил новую лабораторию на понтоне, пришвартовав ее на озере Меларен за городской чертой Стокгольма. Потребность в нитроглицерине росла по мере того, как стали понятны его преимущества перед менее мощным порохом. К 1868 году Нобель основал заводы в одиннадцати странах Европы и даже открыл дело в Сан-Франциско.
Нитроглицерин часто был загрязнен кислотой, использовавшейся в производстве и медленно разлагавшейся. Образующиеся при этом газы иногда выбивали пробки, закрывавшие цинковые емкости, в которых нитроглицерин перевозили по морю. Кроме того, кислота разъедала баки и нитроглицерин начинал вытекать. Для изоляции баков и впитывания вытекающей жидкости использовали древесные опилки, однако этих мер было явно недостаточно. Невежество приводило к чудовищным катастрофам. Однажды нитроглицерин по ошибке использовали для смазки колес экипажа, перевозившего взрывчатку. Естественно, это привело к ужасным последствиям. В 1866 году на складе “Уэллс фарго” в Сан-Франциско взорвалась партия нитроглицерина, в результате чего погибли четырнадцать человек. В том же году пароход “Юропиан” водоизмещением семнадцать тысяч тонн взорвался у атлантического берега Панамы при выгрузке нитроглицерина. Погибли 47 человек, убытки составили более миллиона долларов. В том же 1866 году взрывами были уничтожены нитроглицериновые заводы в Германии и Норвегии. Это вызвало обеспокоенность правительств многих стран. Во Франции и Бельгии оборот нитроглицерина был запрещен. Такой же запрет предполагалось ввести и в других странах, несмотря на растущую потребность в этой невероятно мощной взрывчатке.
Нобель начал искать пути стабилизации нитроглицерина без потери мощности. Очевидным путем казалось переведение нитроглицерина в твердую форму, поэтому Нобель начал проводить эксперименты по смешиванию маслянистого нитроглицерина с такими нейтральными твердыми веществами, как древесные опилки, цемент и порошок древесного угля. До сих пор ведутся споры, было ли изобретение динамита результатом систематических поисков или счастливой случайностью. Даже если это открытие произошло случайно, Нобель оказался достаточно прозорлив, чтобы понять: кизельгур — рыхлый кремнийсодержащий природный материал, который иногда использовали в качестве упаковочного материала вместо древесной стружки, может впитывать вытекающий жидкий нитроглицерин, при этом оставаясь пористым. Кизельгур, иначе называемый диатомитом или горной мукой, представляет собой окаменевшие останки мелких морских животных или водорослей и используется в качестве фильтра при производстве рафинированного сахара, в качестве изолятора, а также для полировки металлических изделий. Дальнейшие испытания показали, что при смешивании жидкого нитроглицерина с кизельгуром (3:1) происходит образование густой пасты с плотностью шпаклевки. Кизельгур стал наполнителем для нитроглицерина, и это снизило скорость распада нитроглицерина. Теперь взрыв можно было контролировать.
Нобель назвал смесь нитроглицерина с кизельгуром динамитом (от греч. dynamis — сила). Ему можно придать любую форму, он не подвержен разложению и не взрывается самопроизвольно. К 1867 году фирма “Альфред Нобель и компания” начала производить динамит, запатентованный как “безопасный взрывчатый порошок Нобеля”. Вскоре во всем мире появились заводы по производству динамита, и состояние Нобеля начало приумножаться. Может показаться странным, что Нобель, создатель оружия, был пацифистом, однако вся жизнь этого человека полна противоречий. В детстве он был болезненным ребенком, никто не ожидал, что он доживет до зрелости, однако он пережил своих родителей и братьев. Его одновременно называли застенчивым и чрезвычайно деликатным, одержимым и крайне недоверчивым, нелюдимым и очень щедрым. Нобель был твердо уверен в том, что создание страшного оружия сможет удержать людей от войны, однако прошло более столетия, появилось новое ужасное оружие, а надежда Нобеля не оправдалась. Он умер в 1896 году, работая в одиночестве за своим столом в Сан-Ремо, в Италии. Свое гигантское состояние он завещал использовать как фонд для ежегодного вручения премий за научные достижения в области химии, физики, медицины, литературы и борьбы за мир. В 1968 году Банк Швеции в память об Альфреде Нобеле учредил премию в области экономики. Теперь эта премия тоже носит название Нобелевской, хотя сам Нобель об этом не распоряжался.
