Особенности способов получения и реакционной способности двух- и многоатомных спиртов.
Наряду со способами аналогичными способам получения одноатомных спиртов, двухатомные спирты могут быть получены путём окисления алкенов по Вагнеру, например:
При присоединении воды к эпоксисоединениям так же получаются диолы:
Трёхатомный спирт – глицерин может быть получен, например, по приведённой ниже цепи превращений:
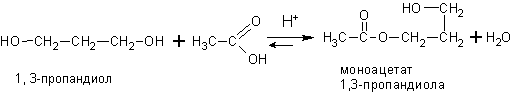
Двух- и многоатомные спирты вступают во все те же реакции, в которые вступают одноатомные спирты, правда реакция может идти ступенчато, например:
При взаимодействии многоатомных спиртов с гидроксидами тяжелых металлов, таких как хром, свинец , висмут и медь в щелочной среде образуются хорошо растворимые в воде комплексные соединения. Медный комплекс ярко окрашен в сине-фиолетовый цвет. Для образования комплексов необходимо, чтобы гидроксильные группы в спиртах находились у соседних атомов углерода.
Незаряженные комплексы такого типа могут из водного раствора переходить в органические растворители , например, в 1,2-дихлорэтан или в хлороформ.
В трёхатомных спиртах, а так же и в спиртах с большим количеством гидроксильных групп, в образовании комплекса участвуют только два стоящих рядом гидроксила. Например, в комплексе из глицерина и катиона меди (II):
ПРИМЕНЕНИЕ И МЕДИКО-БИОЛОГИЧЕСКОЕ
ЗНАЧЕНИЕ СПИРТОВ
Простейший спирт – метанол очень широко применяется как исходное сырьё в многочисленных органических синтезах. Например, для синтеза формальдегида, метилмеркаптана, метиламина, сложных эфиров многих карбоновых кислот, которые в свою очередь применяются как пластификаторы, растворители, душистые вещества в парфюмерии и компоненты пищевых эссенций. Очень важным является синтез уксусной кислоты из метанолаи угарного газа:
Этот способ производства уксусной кислоты вытеснил вредный с позиции экологии способ её синтеза из ацетилена через ацетальдегид по Кучерову, так как в нём получается большое количество ртутьсодержащих сточных вод.
Не менее важным является использование метанола в синтезе метилакрилата из ацетилена , угарного газа и этого спирта:
Метанол используется также как растворитель, антифриз и моторное топливо. Им растворяют пробки, образующиеся из замёрзшего конденсата в газопроводах на крайнем севере.
Метанолчрезвычайно токсичен. 7- 10 мл его достаточно для того, чтобы мужчина с массой тела около 70 кг ослеп. Выпитые по ошибке 25 – 30 мл приводят к летальному исходу. Важно знать, что токсичен не сам метанол, а продукты его окисления под действием ферментов – формальдегид и муравьиная кислота. Поэтому, если занять ферменты окислением гораздо менее опасного для человека этанола (в виде водки, принимаемой постоянно в течение трёх суток), то пациента можно спасти.
В мире производится около 30 миллионов тонн метанола в год.
Этанол применяется в производстве ацетальдегида, хлороформа, диэтилового эфира, этилацетата, уксусной кислоты, дивинила, многих душистых веществ для парфюмерии. Кроме того он применяется как растворитель лакокрасочных материалов, взрывчатых и лекарственных веществ. Этиловый спирт, получаемый путём брожения пищевого сырья, применяется при изготовлении алкогольных напитков, растворения и перекристаллизации лекарственных препаратов. Этанол – наркотик, возбуждающе действующий на организм; его постоянное (важно знать любителям пива) или периодическое, но неумеренное употребление ведёт к алкоголизму – тяжёлой болезни, заканчивающейся циррозом печени и полной деградацией личности. В мире производится около 3 миллионов тонн этанола в год.
Пропанол-1 широко применяется как растворитель для восков, природных и синтетических смол. Как исходное вещество в синтезе лекарственных препаратов, душистых веществ для парфюмерных композиций, сложных эфиров – растворителей лакокрасочных материалов, пестицидов.
Пропанол-2 широко применяется как растворитель ацетатов целлюлозы, этилцеллюлозы, целлофана, эфирных масел, алкалоидов. Как исходное вещество он применяется в синтезах ацетона, изорпопиламина, изопропилацетата , косметических, моющих и лекарственных средств.
Изопропиловый спирт входит в состав жидкостей для размораживания замков и в состав «жидкого ключа», помогающего отворачивать гайки, например, на колёсах автомобилей.
Бутанол-1 применяется как растворитель лакокрасочных материалов, как исходное вещество в синтезе душистых веществ для парфюмерных композиций, пластификаторов для полимерных материалов, гербицидов.
Бутанол-2 применяется как высокооктановый ( ОЧ = 110 ) компонент моторных топлив, как исходное вещество в синтезах. В мире производится около 1 миллиона тонн бутанола-2 в год.
Изобутиловый спирт ( 2-метилпропанол-1 ) применяется как растворитель лакокрасочных материалов и азотнокислых эфиров целлюлозы (взрывчатые вещества, ракетное топливо). Он используется так же в синтезах душистых веществ, пластификаторов для полимеров, гербицидов.
Трет-бутиловый спирт ( 2-метипропанол-2 )в огромных масштабах используется для получения путём дегидратации изобутилена ( 2-метилпропена ), который идёт как мономер для производства полиизобутилена. Последний с малой степенью полимеризации ( 15 – 50 ) служит как присадка к моторным маслам, а с большой (десятки тысяч) как материал для защиты от коррозии аппаратов большого объёма в химической промышленности. Трет-бутиловый спирт используется так же в производстве инициаторов полимеризации.
Высшие спирты ( С6 – С20 ) применяются по-разному в зависимости от длины углеродной цепи. Спирты ( С6 – С8 ) как флотореагенты, как экстрагенты солей Co, V и U, как растворители для синтетических смол, как сырьё в производстве пластификаторов. Спирты ( С10 – С20 ) как компоненты пеногасителей, смазочно-охлаждающих жидкостей, текстильно-вспомогательных веществ, косметических составов. Метакриловые эфиры спиртов( С7 – С9 ) как депрессорные присадки к моторным топливам и маслам. Натровые и аммонийные соли сернокислых эфиров спиртов( С10 – С20 ) как синтетические моющие средства, способные стирать в жёсткой и морской воде.
Этиленгликоль ( 1,2-этандиол ) очень широко применяется как компонент антифризов для охлаждения двигателей внутреннего сгорания. Эти антифризы обеспечивают хороший отвод тепла на рабочих режимах двигателя и не замерзают при отрицательных температурах, как вода. Отечественная промышленность выпускает антифризы «Тосол –А 40» и «Тосол –А 60». Первый содержит 40% этиленгликоляи 60% воды и предназначен для работы в средней полосе России, а второй содержит 60% этиленгликоля и 40% воды и используется на крайнем севере. Кроме того этиленгликоль широко применяется в синтезе полиэтилентерефталата, из которого производят волокно лавсан ( за границей терилен, дакрон, ямболен и другие ). Из этиленгликоля получают так же многочисленные сложные эфиры. Например, дибутиловый эфир этиленгликоляиспользуют как реагент для выделения Bi(III), Po(IV) и U(IV) из водных растворов. Этиленгликоль входит так же в состав гидравлических, тормозных и закалочных жидкостей. В мире производится около 20 миллионов тонн этиленгликоля в год.
Глицерин ( 1,2,3-триоксипропан, 1,2,3-пропантриол ) применяется для производства тринитрата 1,2,3-пропантриола, неправильно называемого нитроглицерином. Нитрогглицерин одновременно является взрывчатым веществом и препаратом для снятия сердечных приступов.
Глицерин является сырьём в производстве алкидных смол, акролеина, полиуретанов. Он входит в состав эмульгаторов, моющих средств, антифризов, косметических и парфюмерных препаратов, медицинских мазей и растворов, кремов для обуви. В некоторых алкогольных напитках до 15%
глицерина. Глицерин абсолютно не токсичен. В виде фрагмента он входит в состав всех жиров и некоторых других липидов.
Пентаэритрит (2,2-диметилол-1,3-пропандиол) широко применяется как исходное вещество в синтезе синтетических смазочных масел повышающих моторесурс турбозубчатых агрегатов в 5 – 6 раз. Он является также сырьём в производстве алкидных смол, тетранитропентаэритрита, поверхностно-активных веществ и пластификаторов.
Поливиниловый спирт применяется в производстве волокон для хирургии, как компонент кровезаменяющих составов и некоторых готовых выпускных форм, например, «йодинола», как эмульгатор. В мире производится около 1 миллиона тонн поливинилового спирта в год.
Содержание
Кислородсодержащие органические соединения………………………………………………………………..1 Спирты. Определение……………………………………………………………………………………………………………..1
Классификация спиртов:
по типу атомов углерода, контактирующих с функциональной группой «ОН»……………………1
по количеству гидроксильных групп ……………………………………………………………………………………..2
Номенклатура и изомерия спиртов ……………………………………………………………………………………….2
Способы получения спиртов:
1. Из алканов…………………………………………………………………………………………………………………….4
2. Из алкенов…………………………………………………………………………………………………………………….4
3. Из алккинов…………………………………………………………………………………………………………………..4
4. Из алкадиенов………………………………………………………………………………………………………………5
5. Из галоидных алкилов………………………………………………………………………………………………….6
6. Из дигалоидных производных…………………………………………………………………………………….7
7. Из тригалоидных производных……………………………………………………………………………………7
8. Из аминов……………………………………………………………………………………………………………………..7
9. Из альдегидов и кетонов по реакции Меервейна-Понндорфа-Верлея……………………..7
10. Из альдегидов и кетонов путём гидрирования в присутствии катализаторов………….9
11. Из альдегидов и кетонов и галоидных алкилов путём синтезов Гриньяра…………….11
12. Из карбоновых кислот через галогенангидриды, которые гидрируют……………………11
13. Из алкоголятов……………………………………………………………………………………………………………12
14. Из сложных эфиров путём автокаталитического гидролиза…………………………………….13
15. Из сложных эфиров путём кислотного гидролиза…………………………………………………….13
16. Из сложных эфиров путём щелочного гидролиза…………………………………………………….14
17. Из сложных эфиров восстановлением по Буво и Блану……………………………………………15
18. Из сложных эфиров восстановлением комплексными гидридами…………………………15
Физические свойства спиртов…………………………………………………………………………………………16
Отношение спиртов к свету…………………………………………………………………………………………….16
Агрегатное состояние спиртов при различных температурах……………………………………….16
Зависимость температур плавления спиртов-изомеров от строения…………………………..16
Межмолекулярные водородные связи в спиртах………………………………………………………….17
Влияние водородных связей в спиртах на их физические свойства……………………………..17
Зависимость температур кипения спиртов-изомеров от строения……………………………….17
Вязкость спиртов………………………………………………………………………………………………………………17
Растворимость спиртов в воде и органических растворителях……………………………………..17
Спирты как растворители органических и неорганических веществ…………………………….18
Запах спиртов…………………………………………………………………………………………………………………..18
Химические свойства спиртов…………………………………………………………………………………………18
Спирты как слабые кислоты…………………………………………………………………………………………….19
Реакция спиртов с ацетиленидами металлов…………………………………………………………………19
Реакция спиртов с амидами щелочных металлов………………………………………………………….19
Реакция спиртов со щелочами……………………………………………………………………………………….19
Активированное нуклеофильное замещение атомов галогенов в ароматическом
ядре равновесной смесью спиртов и их алкоголятов……………………………………………………19
Реакция спиртов с активными металлами……………………………………………………………………..19
Абсолютирование этанола………………………………………………………………………………………………19
Гидролиз алкоголятов……………………………………………………………………………………………………..20
Реакция спиртов с концентрированными галогеноводородными кислотами
( реактивом Лукаса )………………………………………………………………………………………………………..20
Реакция спиртов с кислородсодержащими неорганическими кислотами…………………..20
Реакция спиртов с аммиаком и аминами……………………………………………………………………….21
Межмолекулярная дегидратация спиртов…………………………………………………………………….21
Внутримолекулярная дегидратация спиртов…………………………………………………………………22
Реакция спиртов с алкенами…………………………………………………………………………………………..22
Реакция спиртов с ацетиленом……………………………………………………………………………………….23
Реакция спиртов с алкадиенами……………………………………………………………………………………23
Реакции алкоголятов с галоидными алкилами……………………………………………………………..23
Реакция спиртов с альдегидами…………………………………………………………………………………….23
Реакция спиртов с полуацеталями………………………………………………………………………………..24
Реакция спиртов с кетонами………………………………………………………………………………………….24
Реакция спиртов с полукеталями…………………………………………………………………………………..24
Реакция спиртов с альдегидами и кетонами по Меервейну-Понндорфу-Верлею……..24
Реакция спиртов с карбоновыми кислотами – реакция этерификации………………………25
Реакция спиртов со сложными эфирами – реакция переэтерификации…………………….25
Горение спиртов…………………………………………………………………………………………………………….25
Окисление первичных спиртов до альдегидов…………………………………………………………….25
Окисление вторичных спиртов до кетонов……………………………………………………………………25
Дегидрирование первичных спиртов до альдегидов…………………………………………………..26
Дегидрирование вторичных спиртов до кетонов…………………………………………………………26
Окисление спиртов сильными окислителями в жидкой фазе в кислой среде…………..26
Особенности способов получения и реакционной способности двух- и много-
атомных спиртов…………………………………………………………………………………………………………….27
Получение диолов из алкенов по Вагнеру…………………………………………………………………….27
Получение диолов из эпоксидных соединений…………………………………………………………….28
Получение глицерина из простых и неорганических веществ……………………………………..28
Ступенчатая этерификация диолов карбоновыми кислотами………………………………………28
Образование комплексных соединений из гидроксидов тяжёлых металлов
и двух- или трёхатомных спиртов…………………………………………………………………………………..29
Применение и медико-биологическое значение спиртов……………………………………………29
Применение метанола и его токсические свойства………………………………………………………29
Применение этанола, его токсические свойства и медико-биологическое значение…………………………………………………………………………………………………………………………..30
Применение пропанола-1 ……………………………………………………………………………………………..30
Применение пропанола-2……………………………………………………………………………………………….30
Применение бутанола-1 ………………………………………………………………………………………………..30
Применение бутанола-2 …………………………………………………….…………………………………………..30
Применение изобутилового спирта……………………..…………………………………………………………31
Применение трет-бутилового спирта……………………..……………………………………………………31
Применение высших спиртов……………………..………..…………………………………………………………31
Применение этиленгликоля…………………………………………………………………………………………….31
Применение и медико-биологическое значение глицерина………………………….……….…….31
Применение пентаэритрита…………………………………………………………………………………………….31
Применение поливинилового спирта и его и медико-биологическое значение………….32
Содержание………………………………………………………………………………………………………………………32
