Реакция с образованием слабого электролита.
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального
Образования (ГОУ ВПО)
Уфимский государственный нефтяной технический университет
Филиал УГНТУ в г. Салавате
Общая неорганическая химия
Отчет по лабораторной работе №5
ГИДРОЛИЗ
ХТП -220700.65-01.05 ЛР
Исполнил:
Ст.гр. БАТ 12-21 Е.В. Новоженин
Руководитель
Ассистент: Р. Р. Вахидов
Салават 2010
Цель: Исследование явления гидролиза растворов.
Ход работы.
Дегидратация медного купороса и гидратация сульфата меди.
Выполнение опыта: в сухую пробирку поместить 2-3 лопаточки медного купороса. Закрепите пробирку в штативе, так чтобы дно ее было чуть выше, чем отверстие. Нагрейте соль, находящуюся в пробирке (в начале нагревают всю пробирку, а потом дно, т.е. саму соль). Соль посветлела. Когда вся соль посветлеет, прекратите нагревание, дайте пробирке остыть. Затем к остывшей соли добавьте несколько капель воды. Соль снова приобрела прежний цвет (синий).
CuSO4 * 5 H2O → CuSO4 + 5 H2O ↑
Синий Бесцветный
CuSO4 + 5 H2O → CuSO4 * 5 H2O
Бесцветный Синий
Окраска некоторых кислотно-основных индикаторов в кислой, нейтральной и щелочной среде.
Выполнение опыта: налейте в 6 пробирок по 10 капель дистиллированной воды. В две крайние левые добавьте 2 капли 2н. раствора НСl, в две крайние правые 3 капли 2н. раствора NaOH, а в две средние ничего не добавляйте. Теперь в три пробирки внесите по 1 капле фенолфталеина, в другие три по 1 капле метил - оранжевого. Отметьте окраску индикаторов в каждой из пробирок.
Запись данных опыта: результат опыта записан в виде таблицы:
Таблица 1
| Индикатор | Интервал | Окраска индикатора в различных средах | ||
| кислая | щелочная | нейтральная | ||
| Фенолфталеин | 8,0-9,8 | Бесцветный (pH<8.0) | Малиновый (pH>9.8) | Бледно- малиновый (8.0<pH<9.8) |
| Метилоранжевый | 3,1-4,4 | Малиновый) (pH<3.1) | Желтый (pH>4.4) | Оранжевый (3.1<pH<4.4) |
Смещение ионного равновесия
Выполнение опыта: б) в две пробирки внесите по одной капле фенолфталеина. В одну из пробирок внесите 1- 2 лопаточки сухой соли хлорида аммония.
Запись данных опыта:
1. Сl - + NH4 + + H2O + Митилоранж → Малиновый (Н++Cl-+NH4OH)
Сильная Слабое
кислота основание
В этом опыте наблюдается гидролиз хлорида аммония. Так как соляная кислота является сильной кислотой а, гидроксид аммония слабым основанием то, их соль будит иметь кислую реакцию.
Реакция с образованием слабого электролита.
Выполнение опыта: а) внести в пробирку по 2-3 капли хлорида железа и такое же количество едкого натра.
FeCl3+3 NaOH= Fe(OH)3  +3NaCl
+3NaCl
Fe 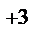 +3Cl
+3Cl 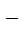 +3Na
+3Na 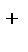 +3OH =Fe(OH)3
+3OH =Fe(OH)3  +3Cl
+3Cl 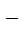 +3Na
+3Na 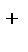
Fe 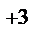 +3OH
+3OH 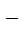 = Fe(OH)3
= Fe(OH)3 
Во вторую пробирку внести несколько капель ацетата натрия и несколько капель серной кислоты (1:1), перемешать раствор стеклянной палочкой и слегка нагреть. Определите по запаху, что образовалась уксусная кислота.
2CHC3OONa+ H2SO4=2CHC3OOH+ Na2SO4
2H 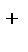 +2CHC3OO
+2CHC3OO 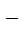 +2Na
+2Na 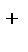 +SO4
+SO4 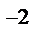 =2CHC3OOH+ 2Na
=2CHC3OOH+ 2Na 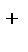 +SO4
+SO4 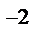
CHC3OO 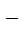 +H
+H  CHC3OOH
CHC3OOH
б) в третью и четвертую внесите по 5-7 капель раствора карбоната натрия. Проверьте наличие в растворе иона СО3, для чего в одну пробирку добавьте несколько капель хлорида кальция.
CaCl2 + Na2CO3 = CaCO3↓ +2NaCl
Ca 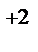 +2Cl
+2Cl 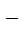 +2Na
+2Na 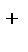 + CO3
+ CO3 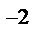 = CaCO3↓ +2Na
= CaCO3↓ +2Na 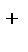 + CO3
+ CO3 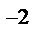
Ca 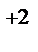 + CO3
+ CO3 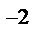 = CaCO3 ↓
= CaCO3 ↓
В другую пробирку добавьте несколько капель серной кислоты (1:1) и наблюдайте выделение газа. Пробирку слегка подогрейте, дождитесь конца реакции и добавьте несколько капель раствора хлорида кальция, осадок не выпадает.
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
2H 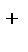 + SO4
+ SO4 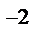 +Na
+Na 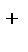 + CO3
+ CO3 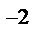 = H2O +CO2↑ +2Na
= H2O +CO2↑ +2Na 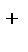 + SO4
+ SO4 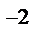
2H 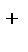 + CO3
+ CO3 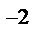 = H2O +CO2↑
= H2O +CO2↑
