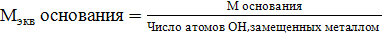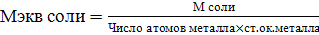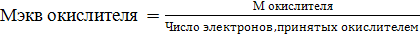Способы выражения концентрации растворов. Количественной характеристикой раствора служит его концентрация, то есть количество растворенного вещества в определенном количестве раствора или
Количественной характеристикой раствора служит его концентрация, то есть количество растворенного вещества в определенном количестве раствора или растворителя. Различают массовую долю, молярную и нормальную концентрации. В аналитической химии наряду с общими химическими понятиями широко используют ряд таких понятий, которые присуще только ей и помогают характеризовать состав раствора. К ним относятся титр, эквивалент, титр по определяемому веществу. Рассмотрим каждый из способов определения концентрации вещества.
1. Массовая доля (ω) - отношение массы соответствующего компонента в растворе к общей массе этого раствора. Выражается в единицах или процентах.
ω (х)= 
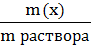
Численно массовая доля равна числу граммов вещества, растворенного в 100г раствора.
2. Молярная концентрация (См) - отношение количества растворенного вещества к объему раствора. Численно (См) равна количеству молей растворенного вещества, содержащегося в 1 л. раствора). Выражается она в моль/л. Сокращенно пишут М. Например, 2М (NaOH).
См= 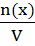
1моль/л = 1М раствор – одномолярный раствор (в 1 л раствора содержится 1 моль растворенного вещества);
0,1М – децимолярный раствор;
0,01М – сантимолярный раствор;
0,001М – милимолярный раствор.
3. Нормальная концентрация (молярная концентрация эквивалента, СN)- количество моль- эквивалентов вещества, содержащегося в 1 л раствора.
СN= 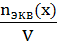
Единица измерения моль-экв/л, Сокращенно обозначается буквой N. Например, 0.1N HCL означает, что в 1 литре такого раствора содержится 0,1моль- эквивалент НСl.
Эквивалентом вещества называется такое количество его, которое взаимодействует с одним моль атомов водорода или вообще с одним эквивалентом любого другого вещества. Обозначается эквивалент Э (Х), выражается в молях. Масса одного эквивалента вещества называется эквивалентной массой, обозначается Мэкв, выражается в г/моль-экв. Эквивалент в большинстве случаев – величина переменная и зависит от типа реакции.
Способы расчета Мэкв.
· 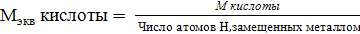
Понятие эквивалентов в окислительно-восстановительных реакциях то же, что в реакциях обмена. Однако способ расчета различен:
Закон эквивалентов предложен в 1814г. И.Рихтером: «Вещества взаимодействуют и получаются в массовых количествах прямо пропорционально их эквивалентам». Математическое выражение этого закона:
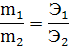
m1, m2- массы веществ, Э1, Э2- эквиваленты веществ.
Пропорция не изменится, если поменять местами m2 с Э1. Тогда получим
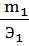 =
= 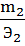
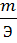 =
= 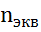
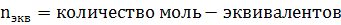
Следствие закона: Объемы реагирующих растворов обратно пропорциональны их нормальным и молярным концентрациям:
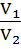 =
= 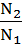 или
или 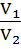 =
= 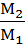
4. Титр (Т)- масса растворенного вещества, содержащаяся в 1 мл раствора, выраженная в граммах. Определятся по формуле:
Т= СN·Мэкв/1000
Раствор с известным титром называется титрованным раствором.