Измерение напряжения электрохимических систем с ионоселективными электродами

 Для измерения потенциала ионоселективного электрода его нужно соединить с любым электродом сравнения. Тогда получим, например для стеклянного электрода
Для измерения потенциала ионоселективного электрода его нужно соединить с любым электродом сравнения. Тогда получим, например для стеклянного электрода


 (–) Ag AgCl, HCl Стекло HCl KCl, Hg2Cl2 Hg (+)
(–) Ag AgCl, HCl Стекло HCl KCl, Hg2Cl2 Hg (+)
a1 a2 насыщ.
φ1 φ2 φ3 φ4 φ5
выражение для напряжения:
Ер = φ5 + φ4 + φ3 + φ2 + φ1
Поскольку скачки потенциала φ5, φ1 и φ2 постоянны, а φ4 можно считать близким к нулю, то
Ер = φΣ + φ3
Где φΣ — сумма постоянных скачков потенциала.
Однако, если нужно с помощью ионоселективного электрода измерить активность а2 электролита, то небезразлично, какой из электродов сравнения будет выбран. Для схемы, изображенной выше, получим
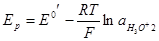
с точностью до значения диффузионного потенциала. Если в качестве электрода сравнения взять хлорсеребряный в том же растворе, то уравнение для напряжения примет вид:
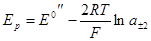
Наконец, если электродом сравнения будет водородный электрод в том же растворе, то
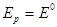 ’’’
’’’
и водородная функция вообще будет отсутствовать. Это связано с тем, что потенциалы водородного и стеклянного электродов одинаково реагируют на изменение активности ионов водорода.
В случае ионоселективного электрода, обратимого относительно металлических ионов (например, ионов кальция)
(–) Ag | AgCl, CaCl2 | Мембрана | СаС12 | КС1, Hg2Cl2 | Hg (+)
a2 a1 насыщ.
получается та же картина. Напряжение будет определяться уравнением:
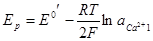
Замена каломельного электрода хлорсеребряным в том же растворе хлорида кальция приведет к выражению:
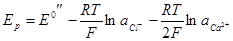
или
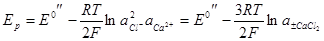
Если же ионоселективный электрод обратим относительно какого-нибудь аниона (например, NO3–), то схема системы с насыщенным каломельным электродом сравнения будет:
(–) Pt (H2) | HNO3 | Мембрана | HNO3 | KCl, Hg2Cl2 | Hg (+)
насыщ.
и при φд →0
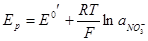
Если в этом случае насыщенный каломельный электрод заменить водородным в растворе азотной кислоты
(–) Pt (H2) | НNO3 | Мембрана | HNO3 | (H2) Pt (+)
то уравнение для напряжения:
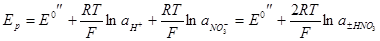
Поскольку во всех этих уравнениях значения стандартных напряжений не поддаются расчету, то активности определяют с помощью градуировочных графиков, для построения которых измеряют напряжение системы при нескольких различных концентрациях (активностях) электролита в стандартных растворах. Концентрации электролита в стандартных растворах должны быть точно определены и не должны изменяться во времени. При измерении рН растворов применяют стандартные буферные растворы с известными значениями рН. Затем строят график, откладывая по оси ординат Е, а по оси абсцисс — логарифм активности соответствующего электролита. Если получается прямая линия с углом наклона, отвечающим теории, то ионоселективный электрод является действительно обратимым. Измеряя таким электродом напряжение системы, содержащей электролит неизвестной концентрации, с помощью графика по величине Е непосредственно находят искомое значение активности.
Так как потенциал асимметрии мембранных электродов иногда изменяется во времени, то градуировочная кривая может перемещаться параллельно самой себе. Поэтому перед измерениями необходимо проверить градуировку, определив две-три точки в растворах с известными концентрациями. В связи с тем, что для практических измерений с ионоселективными электродами всегда проводится предварительная градуировка, то в принципе может быть использован любой постоянный электрод сравнения в отдельном (своем) растворе. Последнее, однако, вызывает необходимость учета или элиминирования диффузионного потенциала при изменении концентрации раствора, которое отражается на градуировочной кривой.
