Зависимость скорости реакции от концентрации субстрата.
Зависимость скорости реакции от концентрации субстрата представлена на рисунке 3.
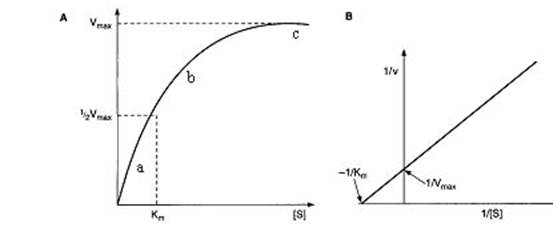
Рис. 3. Зависимость скорости реакции от концентрации субстрата.
А – в координатах V (скорость реакции) и [S] (концентрация субстрата) согласно уравнения Михаэлиса-Ментен; B – в координатах обратных величин (1/V и 1/[S]) согласно уравнения Лайнуивера-Бэрка
На гиперболической кривой графика А выделяют три участка. При низкой концентрации субстрата (участок а) скорость реакции прямо пропорциональна концентрации субстрата и подчиняется кинетике первого порядка. На участке b (реакция смешанного порядка) эта зависимость нарушается. На участке c скорость реакции максимальна и не зависит от концентрации субстрата.
Ферментативная реакция характеризуется формированием фермент-субстратного комплекса [ES], который распадается с образованием свободного фермента и продукта реакции.
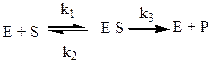
В этом уравнении k1 – константа скорости образования фермент-субстратного комплекса, k2 – константа диссоциации фермент-субстратного комплекса с образованием свободного фермента и субстрата и k3 – константа скорости диссоциации фермент-субстратного комплекса до свободного фермента и продукта реакции.
Л.Михаэлис и М.Ментен предложили уравнение, которое описывает зависимость скорости реакции от концентрации субстрата.



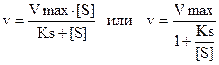
v – скорость реакции при данной концентрации субстрата; Ks – константа диссоциации фермент-субстратного комплекса; Vmax – максимальная скорость реакции.
Ks=k-2/k1 т.е. отношение константы обратной реакции к константе прямой реакции.
Однако данное уравнение описывает только участок а на гиперболической кривой графика А и не учитывает влияния на скорость ферментативного процесса продуктов реакции.
Математическая обработка кривой превращения субстрата в продукт реакции дает значение константы Михаэлиса (Km):

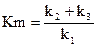
Холдейн и Бриггс заменили в уравнении константу диссоциации на константу Михаэлиса.
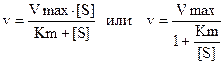
Константа Михаэлиса численно равна концентрации субстрата, при которой скорость реакции равна половине максимальной. Константа Михаэлиса характеризует сродство фермента и субстрата. Высокое сродство фермента к субстрату характеризуется низкой величиной Кm и наоборот. Этот подход можно использовать при анализе любых взаимодействий между молекулами и лигандами, характеризующихся гиперболической зависимостью (эффекты насыщения мест связывания).
Использование графика, предложенного Михаэлисом и Ментен не позволяет точно определить величины Vmax и Km. Для более удобного графического представления Г.Лайнуивер и Д.Бэрк преобразовали уравнение Холдейна и Бриггса по методу двойных обратных величин.
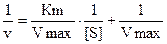
Vmax зависит от константы k3 (kкат) и общей концентрации фермента. Кинетическая константа kкат, называемая числом оборотов, отражает количество молекул субстрата, превращенных в продукт за единицу времени простым активным центром фермента, полностью насыщенным субстратом. Число оборотов большинства ферментов от 1 до 104 за секунду. Величина отношения kкат/Кm используется для оценки эффективности фермента.
Аллостерические ферменты не подчиняются кинетике Михаэлиса-Ментен. У таких ферментов зависимость начальной скорости от концентрации субстрата носит S-образную (сигмоидную) форму. Для аллостерических ферментов полунасыщающую концентрацию субстрата обозначают не Кm, а S0,5.
Физиологические концентрации субстратов обычно близки к величинам Кm и S0,5. Небольшие изменения величин полунасыщающих концентраций субстратов сопровождаются большими изменениями в мощности катализа.
Зависимость скорости реакции от рН среды.Графическое изображение зависимости скорости реакции от величины рН имеет колоколообразную форму. Значение рН, при котором фермент проявляет максимальную активность, называется оптимумом рН (рис. 4, А). Для большинства ферментов оптимум рН равен 6-8. Исключение составляет пепсин, оптимум которого равен 1,5-2,0. При изменении рН в ту или другую сторону от оптимума скорость реакции уменьшается, вследствие ионизации функциональных групп фермента и субстрата, что нарушает образование фермент-субстратного комплекса.
