Методы составления уравнений окислительно-восстановительных реакций. Метод электронного баланса.
Чтобы составить уравнение окислительно-восстановительной реакции, надо знать свойства взаимодействующих веществ и на их основе предугадать образование новых веществ. Окончательно вопрос о продуктах реакции может быть решен экспериментально. Например, при взаимодействии сероводорода с бихроматом калия в кислой среде изменяется цвет раствора из оранжевого в зеленый, характерный для соединений трехвалентного хрома, также раствор мутнеет вследствие выпадения в осадок серы.
Запись исходных и конечных продуктов реакции с указанием степеней окисления атомов, изменяющих ее (степень окисления), выглядит так:
K2Cr+62O7 + H2S-2 + H2SO4 → Cr+32(SO4)3 + S0 + K2SO4
Так как вода может получаться или расходоваться в реакциях, то ее записывают в той или иной части равенства при окончательном подсчете атомов водорода и кислорода.
В приведенных соединениях изменяют степень окисления только хром и сера:
 2Cr+6 + 6е → 2Cr+3 2 1 – окислитель
2Cr+6 + 6е → 2Cr+3 2 1 – окислитель
S-2 – 2е → S0 6 3 – востановитель
Переход Cr+6 → Cr+3 формально отвечает присоединению трех электронов, а переход S-2 → S0 соответствует потере двух электронов. Следовательно, K2Cr2O7 – окислитель, H2S – восстановитель.
Во всех окислительно-восстановительных реакциях общее число электронов, отдаваемых восстановителем, равно общему числу электронов, присоединяемых окислителем. Исходя из этого, подбираем основные коэффициенты для окислителя (1) и восстановителя (3) в уравнении реакции:
K2Cr+62O7 + 3H2S-2 + H2SO4 → Cr+32(SO4)3 + 3S0 + K2SO4
Остальные коэффициенты находят при подсчете баланса других элементов (пока без атомов кислорода и водорода), в данном случае атомов калия, а затем и групп SO42-. По числу атомов водорода в исходных веществах (14) находим число образовавшихся молекул воды (7) и дописываем уравнение реакции:
K2Cr+62O7 + 3H2S-2 + 4H2SO4 = Cr+32(SO4)3 + 3S0 + K2SO4 + 7Н2О
Для проверки правильности подобранных коэффициентов подсчитывают баланс кислорода: в левой и правой частях равенства по 23 атома О.
В тех случаях, когда в реакции число элементов, изменяющих свою степень окисления, больше двух, устанавливают общее число электронов, теряемых восстановителями, и общее число электронов, приобретаемое окислителями, а в остальном поступают обычным образом.
Например:
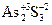 + HN+5O3 + H2O →
+ HN+5O3 + H2O → 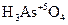 + H2S+6O4 + N+2O
+ H2S+6O4 + N+2O
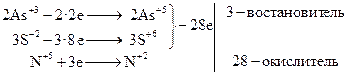
Довольно часто встречаются случаи, когда соединение, кроме выполнения окислительной или восстановительной функции, идет также на связывание продуктов реакции (степени окисления элементов не изменяются).
Рассмотрим составление уравнения подобной реакции на примере взаимодействия перманганата калия с концентрированной соляной кислотой. Перманганат калия – окислитель, соляная кислота – восстановитель и одновременно среда, в которой протекает процесс. Поэтому в уравнении реакции целесообразно формулу соляной кислоты написать дважды:
KMnO4 + HCl + HCl →
окислитель восстановитель среда
Зная, что в кислой среде превращение KMnO4 сопровождается изменением степени окисления марганца от +7 до +2, запишем продукты реакции:
KMn+7O4 + HCl-1 + HCl-1 → Mn+2Cl2 + Cl02 + KCl-1
Составим уравнения электронного баланса:

 Mn+7 + 5 e → Mn+2 1 2 – окислитель
Mn+7 + 5 e → Mn+2 1 2 – окислитель
Cl-1 – 1 е → Cl 5 10 – восстановитель
Так как молекула хлора состоит из двух атомов, оба основных коэффициента удваиваются (соотношение 1:5 должно сохраняться в уравнении реакции):
2KMnO4 + 10HCl + HCl → 2MnCl2 + 5Cl2 + KCl
восст-ль среда
По числу атомов калия в левой части уравнения находим число молекул KCl (2). По числу атомов хлора в правой части уравнения, не изменивших степень окисления, находим коэффициенты перед HCl – средой.
2KMnO4 + 10HCl + 6HCl → 2MnCl2 + 5Cl2 + 2KCl
Определяем число молекул воды и записываем уравнение в окончательном виде:
2KMnO4 + 16HCl → 2MnCl2 + 5Cl2 + 2KCl + 8Н2О
Рассмотренная последовательность составления уравнений окислительно-восстановительных реакций принята в методе электронного баланса.
