Химические свойства аминокислот.
1. Кислотно-основные свойства: Аминокислоты — это амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами. Аминокислоты реагируют как с кислотами, так и с основаниями: H2N-CH2-COOH + HCl à Cl[H3N-CH2-COOH] H2N-CH2-COOH + NaOH à H2N-CH2-COONa + H2O Кислотно-основные превращения аминокислот в различных средах можно изобразить следующей схемой: 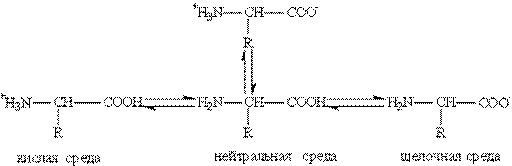 Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин— щелочной (одна группа -СООН, две -NH2). Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин— щелочной (одна группа -СООН, две -NH2). |
| 2. Как кислоты, аминокислоты могут реагировать с металлами, оксидами металлов, солями летучих кислот: 2H2N-CH2-COOH +2 Na à 2H2N-CH2-COONa + H2 2H2N-CH2-COOH + Na2O à 2H2N-CH2-COONa + H2O H2N-CH2-COOH + NaHCO3 à H2N-CH2-COONa + CO2 ↑+ H2O |
| 3. Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир: H2N-CH2-COOH + C2H5OH H2N-CH2-COOC2H5 + H2O |
4. Межмолекулярное взаимодействие α-аминокислот приводит к образованию пептидов. При взаимодействии двух α-аминокислот образуется дипептид. 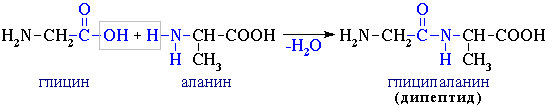 Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH - пептидной связью. Из трех молекул α-аминокислот (глицин+аланин+глицин) можно получить трипептид: H2N-CH2CO-NH-CH(CH3)-CO-NH-CH2COOH глицилаланилглицин Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH - пептидной связью. Из трех молекул α-аминокислот (глицин+аланин+глицин) можно получить трипептид: H2N-CH2CO-NH-CH(CH3)-CO-NH-CH2COOH глицилаланилглицин |
| 6. При нагревании разлагаются (декарбоксилирование): NH2-CH2-COOH → t NH2-CH3 + CO2 амин |
| 7. Декарбоксилирование с помощью щелочи: NH2-CH2-COOH +Ва(ОН)2 → t NH2-CH3 + ВаCO3 + Н2О амин |
| 8. С азотистой кислотой: NH2-CH2-COOH + HNО2 à HO-CH2-COOH + N2 + Н2О |
БЕЛКИ
Белки (полипептиды)– биополимеры, построенные из остатков α-аминокислот, соединенных пептидными (амидными) связями. Образование белковой макромолекулы можно представить как реакцию поликонденсации α-аминокислот:
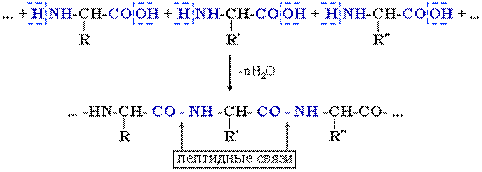
Молекулярные массы различных белков (полипептидов) составляют от 10 000 до нескольких миллионов. Макромолекулы белков имеют стереорегулярное строение, исключительно важное для проявления ими определенных биологических свойств.
Несмотря на многочисленность белков, в их состав входят остатки не более 22 α-аминокислот.
СТРУКТУРА БЕЛКА.
| Первичная структура - определенная последовательность α-аминокислотных остатков в полипептидной цепи. | 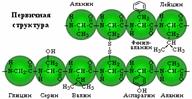 |
 | Вторичная структура - конформация полипептидной цепи, закрепленная множеством водородных связей между группами N-H и С=О. Одна из моделей вторичной структуры - α-спираль. |
| Третичная структура - форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S-, водородных связей, гидрофобных и ионных взаимодействий. |  |
 | Четвертичная структура - агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей |
Физические свойства белков весьма разнообразны и определяютсяих строением. По физическим свойствам белки делят на два класса:
- глобулярные белки растворяются в воде или образуют коллоидные растворы,
- фибриллярные белкив воде нерастворимы.
Химические свойства.
1. Денатурация белка.Это разрушение вторичной и третичной структуры белка с сохранением первичной структуры. Она происходит при нагревании, изменении кислотности среды, действии излучения. Пример денатурации — свертывание яичных белков при варке яиц.
