Термодинамика равновесных процессов
С точки зрения термодинамики обратимые реакции можно рассматривать как бесконечно медленные процессы, протекающие через промежуточные равновесные состояния. Это означает, что при постоянстве концентраций и неизменных внешних условиях они термодинамически обратимы, а равновесная реакционная система должна характеризоваться общими условиями термодинамического равновесия[13].
В этой связи химическое равновесие - это динамическое состояние системы, которое характеризуется:
1. Энергетической выгодностью, т.е. минимальным значением и отсутствием изменений энергии Гиббса (G = Gmin, DG = 0).
2. Постоянством параметров и функций состояния, в том числе концентраций исходных веществ и продуктов реакции.
Таким образом, термодинамически обратимыми процессами можно управлять, а в случае химических процессов (обратимых или необратимых) можно лишь учитывать природу веществ при выборе условий проведения реакции.
Концентрации веществ, которые устанавливаются при химическом равновесии, называются равновесными концентрациями и обозначаются квадратными скобками, например [A].
Схематично состояние химического равновесия можно представить следующим образом:
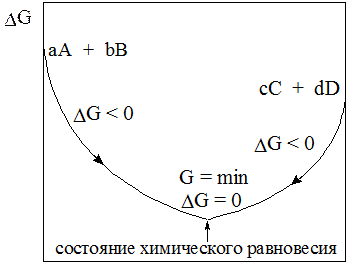
Рис. 7. Изменение энергии Гиббса при достижении химического равновесия.
Рассмотрим обратимую гомогенную реакцию, протекающую в закрытой системе при T = const и p = const, в общем виде:
aA + bB ⇄ cC + dD.
Изменение энергии Гиббса при протекании химической реакции можно определить по формуле:
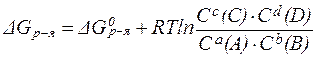 | (29) |
где С(A), С(B), С(C) и С(D) - текущие концентрации веществ.
Это уравнение называется изотермой химической реакции или уравнением изотермы Вант-Гоффа.
Поскольку в состоянии химического равновесия DG = 0, можем записать:
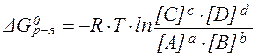 | (30) |
При постоянстве внешних условий подлогарифмическое отношение равновесных концентраций является величиной постоянной и называется константой равновесия K.
Тогда:
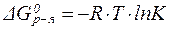 | (30¢) |
Заменив натуральный логарифм на десятичный и подставив значение R = 8,31×10-3 кДж/(моль×K), получим:
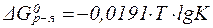 | (30¢¢) |
Это уравнение позволяет производить расчёт изменения энергии Гиббса при протекании химической реакции, а также расчёт константы химического равновесия при различных температурах:
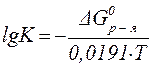 | (30¢¢¢) |
Последнее соотношение позволяет определить характер процесса и предсказать равновесный состав системы.
Если 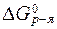 < 0, то K > 1 и равновесие смещено в прямом направлении.
< 0, то K > 1 и равновесие смещено в прямом направлении.
Если 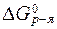 > 0, то K < 1 и равновесие смещено в обратном направлении.
> 0, то K < 1 и равновесие смещено в обратном направлении.
Если K > 105 или K < 10-5, то реакцию считают практически необратимой. В остальных случаях реакции рассматривают как практически обратимые.
