Робота 2.2. Дослідження реакції нейтралізації твердої кислоти розчином лугу.
Мета роботи:визначити константу швидкості та порядок реакції нейтралізації бензойної кислоти водним розчином КОН та обчислити товщину дифузійного шару.
Внаслідок розчинення твердої бензойної кислоти у водному розчині КОН перебігає реакція нейтралізації (2.8). Швидкість цього процесу залежить від швидкості підведення лугу до поверхні поділу твердої та рідкої фаз, тобто від швидкості дифузії.
В склянку ємністю 500 см3 кладуть якір магнітної мішалки і наливають мірним циліндром 300 см3 розчину КОН з концентрацією 0,1 моль/дм3. Склянку з розчином ставлять на столик магнітної мішалки і встановлюють певну швидкість перемішування розчину. Режим перемішування може бути незмінним або першу частину експерименту проводять з однією швидкістю перемішування (3 – 4 заміри), а другу – з іншою (3 – 4 заміри).
Скляну паличку з циліндром бензойної кислоти, розміри якого попередньо вимірюють, закріплюють у штативі над поверхнею розчину по центру склянки. Після цього занурюють циліндр у розчин і одночасно вмикають секундомір. Через певні проміжки часу (бажано кожні 8 хвилин впродовж 40 хвилин) відбирають піпеткою по 10 см3 розчину та титрують його за наявності фенолфталеїну розчином соляної кислоти, що має концентрацію 0,05 моль/ дм3.
Для розрахунків константи швидкості реакції нейтралізації за формулою (2.11) необхідно знати або початкову концентрацію розчину KOH ( 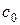 ), або пропорційний цій концентраціїоб’єм HCl (
), або пропорційний цій концентраціїоб’єм HCl ( 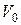 ), який витрачається на титрування лугу. Для цього вихідний розчин КОН двічі – тричі титрують 0,05 – молярним розчином НСl за наявності фенолфталеїну до зникнення малинового забарвлення, відбираючи 10 см3 проби.
), який витрачається на титрування лугу. Для цього вихідний розчин КОН двічі – тричі титрують 0,05 – молярним розчином НСl за наявності фенолфталеїну до зникнення малинового забарвлення, відбираючи 10 см3 проби.
Константу швидкості гетерогенного процесу нейтралізації 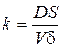 розраховують за формулою:
розраховують за формулою:
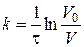 , (2.15)
, (2.15)
де 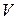 – об’єм розчину HCl, який витрачено на титрування відібраної в певний момент часу проби. Дані досліду та обчислень записують у табл. 2.2 (див. звіт).
– об’єм розчину HCl, який витрачено на титрування відібраної в певний момент часу проби. Дані досліду та обчислень записують у табл. 2.2 (див. звіт).
Якщо дослід виконується за двох режимів перемішування, то для початкової швидкості перемішування константу швидкості обчислюють за формулою (2.15), а для наступної – за формулою:
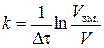 , (2.16)
, (2.16)
де 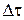 – різниця між часом відбору проб та часом зміни режиму перемішування;
– різниця між часом відбору проб та часом зміни режиму перемішування; 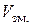 – останній перед зміною швидкості перемішування об’єм HCl, що витратився на титрування реакційної суміші.
– останній перед зміною швидкості перемішування об’єм HCl, що витратився на титрування реакційної суміші.
Використовуючи експериментальні ( 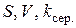 ) та довідникові (
) та довідникові ( 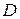 ) дані, розраховують товщину дифузійного шару
) дані, розраховують товщину дифузійного шару 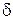 (два значення за різних режимів перемішування).
(два значення за різних режимів перемішування).
Звіт
1. Розміри циліндра бензойної кислоти:
висота 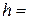 см; діаметр
см; діаметр 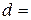 см; площа поверхні
см; площа поверхні 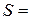 см2.
см2.
2. Результати титрування вихідного розчину КОН:
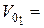 см3,
см3, 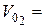 см3,
см3, 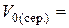 см3.
см3.
3. Результати кінетичних досліджень:
а) побудова графіка залежності 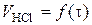 ;
;
б) обчислення за формулами (2.15, 2.16) для табл. 2.2.
Таблиця 2.2. Дані для визначенняконстанти швидкості реакції
нейтралізації твердої бензойної кислоти водним розчином КОН та порядку цього процесу
Час від початку досліду 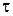 , хв. , хв. | 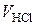 , см3 , см3 | 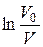 , , 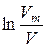 | 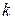 , хв.-1 , хв.-1 |
| … |
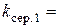 хв.-1
хв.-1
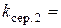 хв.-1
хв.-1
4. Побудова на основі даних табл. 2.2 графіка 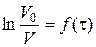 та визначення за ним констант швидкості реакції за різних режимів перемішування:
та визначення за ним констант швидкості реакції за різних режимів перемішування:
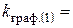 хв.-1;
хв.-1; 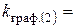 хв.-1
хв.-1
5. Розрахунок товщини дифузійного шару за різних режимів перемішування:
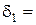 см;
см; 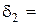 см.
см.
6. Кінетичні рівняння процесу:
7. Висновок.
ЛІТЕРАТУРА: [1, с. 531 – 532; 2, с. 384 – 393; 3, с. 341 – 343; 5, с. 225 – 233; 6, с. 276 – 277, 285 – 287; 7, с. 117; 8, с. 48].
