ДС сплава с полиморфным превращением компонентов
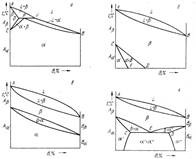
В приведенных выше диаграммах рассматривали первичные превращения, связанные с процессом кристаллизации жидкого сплава.
При вторичной кристаллизации вследствие изменения растворимости с изменением температуры выделяются вторичные кристаллы. Вторичная кристаллизация наблюдается и в том случае, если хотя бы один из компонентов претерпевает аллотропические превращения. Таким образом, превращения в твердом состоянии наблюдаются во всех тех случаях, при которых хотя бы один из компонентов обладает полиморфизмом (т. е. в диаграммах, где компонентами являются Железо, олово, кобальт, марганец, титан, цирконий и некоторые другие элементы).
В рассматриваемых диаграммах с полиморфными превращениями верхняя часть диаграммы характеризует первичную кристаллизацию, нижняя — вторичную.
Если низкотемпературные модификации ограниченно растворимы друг вдруге, авысокотемпературные — неограниченно, то получим сочетаниедиаграмм.
При температуре, соответствующей линии CED,происходит распадβ-твердого раствора с одновременным выделением α'-и α'' твердых растворов:
β → а' + α''.
Превращение протекает аналогично кристаллизации эвтектики, но исходным маточным раствором является не жидкость, а твердый раствор. В отличие от кристаллизации эвтектики из жидкости подобное превращение называется не эвтектическим, а эвтектоидным, а смесь полученных кристаллов — эвтектоидом.
З6.Правило фаз Гиббса
ГИ́ББСА ПРА́ВИЛО ФАЗ, закон термодинамики многофазных многокомпонентных систем, согласно которому число фаз, сосуществующих в равновесии, не превосходит числа независимых компонентов более чем на 2. Установлено Дж. У. Гиббсом (см. ГИББС Джозайя Уиллард) в 1875.
Правило фаз Гиббса определяет соотношение между числом фаз (Ф), компонентов (К), внешних переменных (П) и числом степеней свободы или вариантности (С) термодинамической системы, находящейся в равновесии и записывается следующим образом:
С = К + 2 – Ф;
Цифра 2 в правиле фаз связана с существованием 2-х переменных (температуры и давления), одинаковых для всех фаз. Например, правило фаз Гиббса для постоянного давления запишется как:
С = К +1 – Ф
В этом виде правило фаз применяется для анализа диаграмм фазового равновесия. В случае С = 0 систему принято называть нонвариантной. Она может существовать только при неизменных условиях. Изменение хотя бы одного из параметров системы вызовет изменение числа сосуществующих в системе фаз. При С = 1 система моновариантна. В этом случае только один параметр может быть изменен без одновременного изменения числа фаз; при С = 2 система дивариантна и т. д.
Правило фаз справедливо, если фазы однородны во всем объеме, имеют достаточно большие размеры и отсутствуют полупроницаемые перегородки. Если в системе не происходит химических превращений, то число независимых компонентов равно числу простых веществ, из которых состоит смесь. Если в системе возможны химические взаимодействия, то условия равновесия включают уравнения химических реакций.
Правило фаз Гиббса является основой физико-химического анализа сложных систем, используется для классификации различных случаев химического равновесия.
