Тема 33. Типи розрахункових задач. 6 страница
CuCl2 ↔Cu2+ + 2Cl-
Н2О ↔ Н+ + ОН-
Cu2+ + 2e → Cu0 Cu2+ - більш активніший
(-) K: Н+
Cl- - 1e → Cl0 ; 2Cl0 → Cl2 Cl- - більш активніший
(+) A: ОН-
Загальне рівняння електролізу:
CuCl2 + Н2О → Cu0 + Cl2↑ + Н2О
CuCl2 → Cu0 + Cl2↑
3. Електроліз розчинуNaCl
NaCl ↔ Na+ + Cl-
Н2О ↔ Н+ + ОН-
Na+ Н+ - більш активніший
(-) K: Н+ + 1е → Н0; 2Н0 → Н2
Cl- - 1e → Cl0 ; 2Cl0 → Cl2 Cl- - більш активніший
(+) A: ОН-
Загальне рівняння електролізу:
2NaCl + 2Н2О → Н2 + Cl2↑ +2NaOH
Застосування електролізу
1. для одержання активних металів (K, Na, Ca, Mg, Al) і деяких активних неметалів (Cl2, F2).
2.для покриття металічних предметів іншими металами ( нікелювання, хромування оцинкування, золочення, лудіння або лудження) – це явище гальваностегії;
3. явище гальванопластики – цеодержаннякопій із різних барел’єфів статуеток (при цьому виріб оброблюють графітом і використовують як катод і проводять процес електролізу розчину солі малоактивного металу і одержують покриття металом виробу. І це є кліше для одержання копій.
Д/з: Написати схеми електролізу розплавів та розчинів таких солей:
Na2S, FeCl2, FeBr3, HgCl2, CaCl2, KBr, NaI, K2S, CuBr2.
Тема 16. Лужні метали і Кальцій та їх сполуки.
Лужні метали
До лужних металів відносяться елементи І-А групи: Li, Na, K, Rb, Cs, Fr. Цегрупа найтиповіших металів.
На зовнішньому шарі вних тільки один неспарений електрон.
Na0 - 1e = Na+
+1123Na0 1s22s22p63s1 +1123Na+ 1s22s22p63s0
В сполуках лужні метали проявляють такі:
- СО - +1;
- валентність – І;
- заряд йона - +.
Фізичні властивості лужних металів
1. Сріблясто-білого кольору;
2. м’які;
3. легкі (ρ(Li)=0,50 г/мл; ρ(Na) = 0,98 г/мл.)
4. легкоплавкі(температура від +2000С до +280С.)
Лужні і лужно-земельні метали на повітрі є дуже активними і взаємодіють з киснем і водою при звичайних умовах, тому їх зберігають під шаром гасу(жиру).
Хімічні властивості лужних металів
|→ + Cl2 → Me+1Cl
|→ + S → Me+12S
Ме → → |→ + H2 → Me+1H-1 - Na+1H-1! – натрій гідрид
(Li – Fr) |→ + H2O → Me+1OH + H2↑
|→ + HCl → Me+1Cl + H2↑
|→ + Me*Cl → Me+1Cl + Me* |
З киснем лужні метали взаємодіють так: тільки Літій з киснем утворює оксид(Li2O), а всі інші лужні метали утворюють пероксиди формулою (Me2O-12)
4Li + O2 = 2Li2O
2Na + O2 = Na2O2 натрій пероксид
Na2O2 + 2Na = 2Na2O натрій оксид
Якісною реакцією на лужні метали є зміна забарвлення полум’я на певний колір:
- Na -жовте
- K - фіолетове
Лужно-земельні метали
До лужно-земельних металів відносятьсядеякі елементи ІІ-А групи: Сa, Sr , Ba, Ra. Цегрупа типових металів.
На зовнішньому шарі вних два електрони.
Сa0 - 2e = Сa2+
+2040Сa0 1s22s22p63s23р64s2 +2040Сa2+ 1s22s22p63s23р64s0
В сполуках лужно-земельні метали проявляють такі:
- СО - +2;
- валентність – ІІ;
- заряд йона - 2+.
Фізичні властивості лужно-земельних металів
5. Сріблясто-білого кольору;
6. твердіші за лужні метали;
7. легкі (ρ(Са)=1,55 г/мл;)
8. тугоплавкі за лужні метали(t(плавлення)Са = +8510С)
Хімічні властивості лужно-земельних металів
|→ + Cl2 → Me+2Cl2
|→ + S → Me+2S
|→ + H2 → Me+2H2-1 - Ca+2H2-1! – кальцій гідрид
Ме → → |→ + O2 → Me+2O
(Ca - Ra) |→ + H2O → Me+2(OH)2 + H2↑
|→ + HCl → Me+2Cl2 + H2↑
|→ + Me*Cl → Me+2Cl2 + Me* |
Якісною реакцією на лужно-земельні метали є зміна забарвлення полум’я на певний колір:
- Сa -червоний(цегляний)
Лужні і лужно-земельні метали утворюють по одному оксиду, які є типовими основними оксидами.Їх формули: Ме+12О і Ме+2О.
Також вони утворюють по одному гідроксиду, які є лугами. Їх формули:
Ме+1ОН і Ме+2(ОН)2
Добування лужних і лужно-земельних металів
Одержують лужні і лужно-земельні метали у промисловості електрометалургійним способом – електролізом розплавів солей.
Добування натріюметодом електролізу розплаву кухонної солі.
NaCl ↔ Na+ + Cl-
(-) K: Na+ + 1e → Na0
(+) A: Cl- - 1e → Cl0; 2Cl0 → Cl2
Загальне рівняння:
2NaCl → 2Na + Cl2↑
Природні сполуки лужних та лужно-земельних металів і їх застосування
І. Калію:
- KCl – калійна сіль (сильвін); (як калійне добриво)
- K2CO3 - поташ;(калійне добриво, виробництво тугоплавкого скла і кришталю)
- KOH - «їдке калі»; (як електроліт в лужних акумуляторах, виробництва рідкого мила)
- KCl∙MgCl2∙6H2O - карналіт; (як калійне добриво)
- NaCl∙KCl - сильвініт
ІІ. Натрію
- NaCl – кухонна(кам´яна) сіль (галіт); (як смаковий продукт, одержання натрію)
- NaCl∙KCl – сильвініт
- Na2SO4∙10H2O - мірабіліт
- Na2СO3∙10H2O - кристалічна сода
- Na2СO3 - кальцинована сода; (усунення твердості води, одержання звичайного скла, твердого мила)
- NaНСO3 - питна сода ( як розпушувач у харчовій промисловості, у вогнегасниках, для пониження кислотності в шлунку)
- NaОН - «їдкий натр», каустик, каустична сода. (одержання твердого мила, штучних волокон, очищення нафтопродуктів, реакціях гідролізу)
ІІІ. Кальцію.
- СаСО3 - крейда, мармур, вапняк, ракушник; (у будівництві, виготовлення пам’ятників, одержання негашеного вапна, вуглекислого газу)
- СaSO4∙2H2O - гіпс;( одержання паленого гіпсу-алебастру- (СаSO4)2∙0,5Н2О)
- СаО - «негашене вапно»;(одержання гашеного вапна)
- Са(ОН)2 - «гашене вапно», «вапняне молоко», «вапняна вода».(для визначення вуглекислого газу, в будівництві, для побілки стовбурів дерев,виготовлення цукру, для одержання «хлорного вапна», для боротьби з хворобами рослин-бордоська суміш- CuSO4∙5Н2О + Ca(OH)2 )
- СаСО3·MgCO3 – доломіт.
Твердість води
Під твердістю води розуміють наявність у воді солей тільки Магнію та Кальцію, а саме гідрогенкарбонатів, хлоридів і сульфатів:
Ca(HCO3)2 , Mg(HCO3)2 , CaCl2, MgCl2 , CaSO4, MgSO4.
Твердість води поділяється на:
1. Карбонатна або тимчасова твердість .Вона визначається наявністю в ній солей гідроген карбонатів Кальцію та Магнію: Ca(HCO3)2 , Mg(HCO3)2.
2. Не карбонатна або постійна твердість. Вона визначається наявністю в ній солей хлоридів і сульфатів Кальцію та Магнію: CaCl2, MgCl2 , CaSO4, MgSO4.
Методи усунення твердості води
І. Тимчасової або карбонатної твердості.
1. кип’ятіння:
Ca(HCO3)2 = СaCO3↓ + CO2↑ + H2O
Mg(HCO3)2 = MgCO3↓ + CO2↑ + H2O
2. додаванням кальцинованої соди – Na2CO3:
Ca(HCO3)2 + Na2CO3 = СaCO3↓ + 2NaHCO3
Mg(HCO3)2 + Na2CO3 = MgCO3↓ + 2NaHCO3
3. додаванням мила – С17Н35СООNa або С15Н31СООNa:
Ca(HCO3)2 + 2С17Н35СООNa = (С17Н35СОО)2Ca ↓ + 2NaHCO3
Mg(HCO3)2 + 2С17Н35СООNa = (С17Н35СОО)2Mg↓ + 2NaHCO3
ІІ. Постійної або не карбонатної твердості.
1. додаванням кальцинованої соди – Na2CO3:
CaCl2 + Na2CO3 = СaCO3↓ + 2NaCl
MgSO4 + Na2CO3 = MgCO3↓ + Na2SO4
2. додаванням мила – С17Н35СООNa або С15Н31СООNa:
CaCl2 + 2С17Н35СООNa = (С17Н35СОО)2Ca ↓ + 2NaCl
MgSO4 + 2С17Н35СООNa = (С17Н35СОО)2Mg↓ + Na2SO4
Тема 17. Алюміній і Ферум та їх сполуки.
Алюміній та його сполуки
Алюміній знаходиться у ІІІ-А групі.
На зовнішньому шарі внього три електрони. Алюміній – нетиповий метал(перехідний, амфотерний елемент).
Al0 - 3e = Al3+
+1327Al0 1s22s22p63s23р1 +1327Al3+ 1s22s22p63s03р0
В сполуках алюміній проявляє такі:
- СО - +3;
- валентність – ІІІ;
- заряд йона - 3+.
Алюміній – це третій(Оксисен, Силіцій) за поширеністю елемент у земній корі, а серед металів –найбільш розповсюджений - 8%, а залізо - 4%
Фізичні властивості алюмінію
1.Сріблясто-білого кольору;
2. м’який. Дуже пластичний, легко витягується у дріт і прокатується у листи і фольгу. З електропровідністю поступається тільки золоту, сріблу і міді(2/3 міді).
3. легкий (ρ(Al)=2,7 г/мл;)
4. тугоплавкі за лужні метали(t(плавлення)Al = +6600С)
У ряді металів він стоїть біля активних металів, але при звичайних умовах(на відміну від лужних та лужно-земельних металів) не взаємодіє ні з киснем , ні з водою тому, що він зверху покритий тонкою, щільною, прозорою плівкою, яка не допускає до поверхні кисень і воду. Знищити оксидну плівку на алюмінію можна тільки хімічно(не механічно), а саме ртуттю(Hg) або солями Меркурію(Hg(NO3)2).
Хімічні властивості алюмінію
|→ + Cl2 → Al+3Cl3
|→ + S → Al2+3S3
|→ + H2 → Al+3H3-1 - Al+3H3-1! – алюміній гідрид
Al → → |→ + O2 → Al2+3O3 (знищивши оксидну плівку)
|→ + H2O → Al+3(OH)3 + H2↑(знищивши плівку)
|→ + HCl → Al+3Cl3 + H2↑
|→ + Me*Cl → Al+3Cl3 + Me*
На відміну від типових металів алюміній як нетиповий метал взаємодіє з розчинами лугів(подібно як неметали), утворюючи сіль і водень:
2Al + 2H2O + 2NaOH = 2NaAlO2 + 3H2↑
Натрій метаалюмінат
А також алюміній вступає в реакцію з оксидами малоактивних металів і ця реакція називається алюмотермія.
2Al + 3FeO = Al2O3 + 2Fe
Алюміній утворює один оксид, який є амфотерним оксидом (Al2O3).Також він утворює один гідроксид, який є амфотерним гідроксидом(Al(OH)3).
Добування алюмінію
Одержують алюміній у промисловості електрометалургійним способом – електролізом розплавуAl2O3 .
Добування алюмініюметодом електролізу розплавуAl2O3 .
Al2O3 ↔ 2Al3+ + 3O2-
(-) K: Al3+ + 3e → Al0
(+) A: 2O2- - 4e → O20
Загальне рівняння:
2Al2O3 → 4Al + 3O2↑
Природні сполуки алюмінію і їх застосування
1. Al2O3 - корунд ( червоні кристали – рубін, сині кристали – сапфір)
2. Al2O3∙nH2O - боксит (алюмінієва руда)
3. Al2O3∙2SiO2 ∙2H2O - каолініт (складова частина білої глини, а червона глина містить домішки Fe2O3 )
Алюміній використовується:
1. одержання сплавів легких і міцних:
- дюралюміни – це сплав Al + Cu + Mg
- силумін – це сплав Al + Si.
2. виробництво електричних дротів, різної хім..апаратури, фольги.
3. для алітування - це насичення поверхні стальних і чавунних виробів алюмінієм з метою захисту від корозії.
4. виробництва терміту(суміш залізної окалини і алюмінію) при цьому утворюється температура за 20000C, а також для одержання деяких металів методом алюмотермії.
Ферум та його сполуки
Ферум міститься VІІІ-Б групі. Fe - це d-елемент.
На зовнішньому шарі внього два електрони. Ферум –цетиповий метал.
На відміну від лужних, лужно-земельних металів та алюмінію як елементів головних підгруп, Ферум як елемент побічної підгрупи може віддавати електрони як з зовнішнього щару , так із передостаннього d-електронного шару.Тому для ньогохарактерні аж дві ступені окиснення.
Fe0 - 2e = Fe2+
+2656Fe0 1s22s22p63s23р64s2 3d6 +2656Fe2+ 1s22s22p63s23р64s03d6
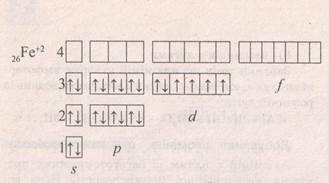
Fe0 - 3e = Fe3+
+2656Fe0 1s22s22p63s23р64s2 3d6 +2656Fe3+ 1s22s22p63s23р64s03d5

В сполуках Ферум проявляє такі:
- СО - +2 і +3;
- валентність – ІІ і ІІІ;
- заряд йона - 2+ і 3+
Фізичні властивості заліза
1. Сріблясто-білого (сірого) кольору;
2. має магнітні властивості на відміну від інших металів ;
3. важкий (ρ(Fe)=7,87 г/мл;)
4. тугоплавкий (t(плавлення)Fe = +15390С)
Хімічні властивості заліза
Залізовідноситься дометалів середньої активностіу ряді металів.
|→ + Cl2 → Fe+3Cl3
|→ + S → Fe+2S
|→ + H2 ≠
Fе → → |→ + O2 → Fe3O4 (тільки при t0 = 10000С)
|→ + H2O → Fe3O4+ H2↑(тільки при t0 = 10000С)
|→ + HCl → Fe+2Cl2 + H2↑
|→ + CuCl2 → Fe+2Cl2 + Cu
|→ + O2 + H2O → Fe(OH)3 (звичайні умови)
іржа
Ферум утворює три оксиди:
1. FeO – ферум (ІІ) оксид (основний оксид)
2. Fe2O3 - ферум (ІІІ) оксид (амфотерний оксид)
3. Fe3O4 (FeO∙Fe2O3) – залізна окалина обо ферум(ІІ,ІІІ) оксид )змішаний оксид)
Ферум утворює два гідроксиди:
1.Fe(OH)2 - ферум (ІІ) гідроксид (нерозчинна основа)
2.Fe(OH)3 -ферум (ІІІ) гідроксид (амфотерний гідроксид).
4Fe(OH)2 + 2H2О + O2 = 4Fe(OH)3
Якісні реакції на солі Fe2+ і Fe3+
І. Fe2+.
1. Реакція з лугами, при цьому утворюється брудно-зелений осад Fe(OH)2:
FeCl2 + 2NaOH = Fe(OH)2 ↓ + 2NaCl
2.Реакція з червоною кров’яною сіллю K3[Fe+3(CN)6]і при цьому утворюється синій осад «турнбулева синь»:
3Fe+2Cl2 + 2K3[Fe+3(CN)6]= Fe3[Fe+3(CN)6]2↓ + 6KCl
«турнбулева синь»
ІІ. Fe3+.
1. Реакція з лугами, при цьому утворюється бурий осад Fe(OH)3:
FeCl3 + 3NaOH = Fe(OH)3 ↓ + 3NaCl
2.Реакція з жовтою кров’яною сіллю K4[Fe+2(CN)6]і при цьому утворюється синій осад «берлінська блакить»:
4Fe+3Cl3 + 3K4[Fe+2(CN)6]= Fe4[Fe+2(CN)6]3↓ + 12KCl
«берлінська блакить»
3.Реакціяз калій роданідом KSCNі при цьому утворюєтьсякриваво-
червоний осад Fe(SCN)3:
FeCl3 + 3KSCN = Fe(SCN)3 ↓ + 3KCl
Природні сполуки Феруму
1. Fe2O3 - гематит, червоний залізняк
2. Fe3O4 (FeO∙Fe2O3) – магнетит, магнітний залізняк, залізна окалина.
3. FeS2 – пірит, залізний або сірчаний колчедан.
Неметалічні елементи
Особливості будови атомів неметалів:
1.Мають велику кількість електронів на зовнішньому шарі (3-8 електронів);
2. мають малий радіус(мала кількість електронних шарів);
3. неметали переважно приймають електрони до завершення зовнішнього шару, тобто переважно є окисниками,але деякі з них можуть і віддавати електрони(крім Флору),тобто виступають і відновниками.
4. Неметали мають найвищу позитивну С.О., яка відповідає номеру групи і найнижчу негативну С.О. таку скільки електронів бракує до завершення зовнішнього шару.
Із 110 елементів – 22 неметали. Це переважно р-елементи, крім Н і Не –s – елементи. Елементи-неметали у періодичній системі знаходяться і правій верхній частині її. Якщо провести діагональ від Бору до Астату, то на лінії діагоналі і зверху неї знаходяться неметали.
Тема 18. Гідроген і галогени та їх сполуки.
Гідроген та його сполуки.
Атоми Гідрогену найбільш розповсюджені у Всесвіті і входять до складу Сонця, зірок, а на Земліє тільки 1%.
Атом Гідрогену у періодичній системі знаходиться у двох групах одночасно:
І-А група (лужні метали) і VІІ-А група(галогени). На одному (першому) електронному шарі він містить 1 електрон, якщо він віддасть , то матиме С.О. +1(як лужні метали), він може також і прийняти електрони і одержить С.О. -1(як галогени).
Атом Н у формулах речовин має такі С.О. : -1, 0 , +1.(найбільш характерна С.О. +1, крім гідридів металів -1.)
Атом Гідрогену (Н) утворює тільки одну просту речовину – Н2 – водень.
За фізичними властивостями водень - це газ, найлегший із всіх відомих (Мr(H2) = 2), нерозчинний у воді(1: 0,019), але розчиняється у металі Платина (Pt) (1: 850).При високих тисках(тисячах атмосфер) водень проходить через металічну обшивку приладів як повітря через губку (вибухонебезпечний !), а також , коли вдихати водень, то голос змінюється.
Хімічні властивості водню
1. реакція горіння:
2Н02 + О2 = 2Н+12О Суміш 2V Н2 + 1V O2 - «гримучий газ»
Н02 - відновник
2. реакція з неметалами:
Н02 + Cl2 = 2Н+1Cl
Н02 + S = Н2+1S
3Н02 + N2 = 2NН3+1
Н02 – відновник
3. реакція з деякими металами (лужними, лужно-земельними і алюмінієм):
2Na + H20 = 2NaН-1 Н02 – окисник
4. реакція з оксидами малоактивних металів:
Fe2O3 + 3Н2 = 2Fe + 3H2O
5. реакція гідрування– це приєднання водню до атомів Карбону при подвійному чи потрійному зв’язку ворнанічних речовинах:
СН2 = СН2 + Н2 → СН3− СН3
етен етан
Добування водню
1. У промисловостіводень одержують при розкладі метану:
2СН4 → С2Н2 + 3Н2
2. У лабораторії водень одержують при взаємодії металів, що стоять у ряду металів до Н з кислотами:
Fe + 2HCl → FeCl2 + H2 ↑
Застосування водню
1. як екологічно чисте пальне;
2. синтез хлороводню і хлоридної кислоти; амоніаку, метанолу;
3. відновлення металів із руд;
4. одержання твердих жирів із олії (реакціях гідрування органічних речовин);
5. для наповнення стратостатів і метеорологічних шарів.
Галогени та їх сполуки
До галогенів відносяться елементи VII-А групи: F, Cl, Br, I, (At – це метал).Галогени – це родина найактивніших неметалів і серед них «король» всіх неметалів – F.
