Заняття 4 карбонові кислоти Вид заняття:Групове заняття 15
Навчальні питання:
1.Карбонові кислоти, склад, будова молекули, фізичні властивості.
2.Ізомерія та номенклатурні назви карбонових кислот.
3.Хімічні властивості кислот, якісні реакції на карбоксильну групу. Добування та застосування карбонових кислот
Навчально-методичне забезпечення: Таблиця Будова молекули оцтової кислоти
Навчальна література: Л-3 с.129-136 Л-4 с. 121-122
ІІІ. Карбонові кислоти
| Визначення | Функціо- нальні групи | Загальна формула | Номенк- латурна назва | Види ізомерії | Будова | Застосування | Добування | Фізичні і Хімічні властивості |
| Карбоно-ві кислоти – органічні речовини в молекуло яких є одна або кілька карбоксильних груп | С = О ОН Карбок-сильна група, складає скла з гідроксогрупи і карбонільної групи | R – С = О ОН СnН2nО2 | Нумерація ланцюга відбувається від карбоксильної групи , закінчення –ова кислота | 1.ізомерія карбонового ланцюга 2.міжкласова ізомерія з естерами | Оксисен в карбонільній групі більш електро- негативний, тому до нього зсувається електронна густина і виникає частковий мінусовий заряд, на гідрогені гідроксо групи виникає частковий додатній заряд. | Оцтова кислота:синтез барвників, пластмас, ліків,штучних волокон,негорючої кіноплівки,ба барвник тканин, пестицидів,естерів, в харчовій промисловост Мурашина кислота:хімічна промисловість-відновник, харчова-як концервант та дезинфікуючий засіб, виробництво каучуку | 1.окиснення спиртів С2Н5ОН +[О]→СН3СООН 2.промисловий спосіб одержання оцтової кислоти 1)крекінг метану СН4→С2Н2+3Н2 2)р-ція Кучерова С2Н2+Н2О→ СН3СНО 3)окиснення оцтового альдегіду киснем повітря СН3СНО+[О]→ СН3СООН 3.окиснення бутану (новий промисловий метод) 2С4Н10+5О2→ 4СН3СООН+2Н2О | 1.дія на індикатор СН3СООН↔СН3СОО-+Н+ 2.взаємодіяз металами 2СН3СООН+Са→(СН3СОО)2Са+Н2 3.взаємодія з оксидами металів 2СН3СООН+СаО→(СН3СОО)2Са+Н2О 4.взаємодія з основами СН3СООН+КОН→СН3СООК+Н2О 5.взаємодія з солями 2СН3СООН+Nа2СО3→2СН3СООNа+Н2О+СО2 6.горіння СН3СООН+2О2→2СО2+2Н2О 7.реакція етерифікації СН3СООН+С2Н5ОН→СН3СООС2Н5 +Н2О 8.взаємодія з галогенами по вуглеводневому радикалу. СН3СООН+СІ2→СН2СІСООН+НСІ |
| Наслідок з будови 1. Між молекулами кислот виникають водневі зв’язки , тому вони рідини 2.водневі зв’язки виникають між молекулами кислоти і води , тому вони добре розчинні. 3.внаслідок сильного відтягування електронної густини від атома Гідрогену, він стає рухливим , може легко заміщуватись на інші атоми тому ці речовини мають сильні кислотні властивості і змінюють забарвлення індикаторів. |
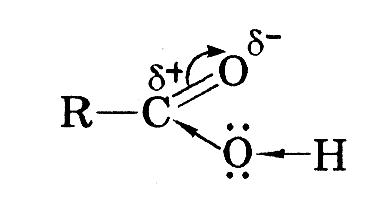
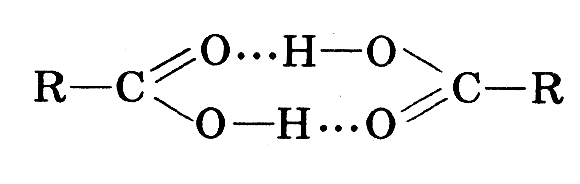
Схема зсуву електронної густини у карбонових кислотах схема утворення водневих зв’язків між молекулами
карбонових кислот
Приклади назви карбонової кислоти згідно міжнародній систематичній номенклатурі
СН3 СН3 СН3
С6Н3 – С5Н – С4 – С3Н – С2Н2 – С1 = О 3,4,4,5-тетраметилгексанова кислота
СН 3 ОН
