Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:

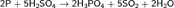
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
 .
.
Вопрос 57. Оксид фосфора (V): получение, свойства.
Получение
1. При горении фосфора на воздухе или в кислороде 4P + 5O2 = 2P2O5
2. При горении фосфина 2РН3 + 4О2 = Р2О5 + 3Н2О
Физические свойства
Белый порошок, без запаха, возгоняющийся при нагревании, очень гигроскорпичен, что позволяет его использовать как эффективное водоотнимающее средство.
Химические свойства
Типичный кислотный оксид
1. при растворении в воде гидратируется с образованием следующих кислот
Р2О5 + Н2О = 2НРО3 метафосфорная кислота
Р2О5 + 2Н2О = Н4Р2О7 пирофосфорная (дифосфорная) кислота
Р2О5 + 3Н2О = 2Н3РО4 ортофосфорная (фосфорная) кислота
2. Взаимодействует с основными оксидами
Р2О5 + 3ВаО = Ва3(РО4)2
3. Взаимодействует с основаниями
Р2О5 + 6NaОH = Na3РО4 + 3H2O
Хотя в Р2О5 фосфор имеет высшую степень окисления +5, сколько-нибудь выраженных
окислительных свойств не проявляет, т.к. эта степень окисления для фосфора очень устойчива
Вопрос 58. Фосфорная кислота: получение, физические и химические свойства. Качественная реакция на ортофосфат-ион.
Получение
1. взаимодействие Р2О5 с водой
Р2О5 + 3Н2О = 2Н3РО4
2. обработка природных фосфатов серной кислотой Са3(РО4)2 + 3H2SО4 = 3CaSО4 + 2Н3РО4
3. в лаборатории окислением фосфора 30%-ной НNО3: 3Р + 5НNО3 + 2Н2О = 3Н3РО4 + 5NO↑
Физические свойства
Бесцветные прозрачные кристаллы, плавящиеся при 420С, хорошо растворимые в воде.
Химические свойства
Ортофосфорная кислота не принадлежит к числу сильных кислот.
1. Как трехосновная кислота диссоцииирует ступенчато
Н3РО4 ↔ Н+ + Н2РО4-
Н2РО4-↔ Н+ + НРО42-
НРО42-↔ Н+ + РО43-
Обычно преобладает первая ступень диссоциации.
2. Фосфорная кислота обладает всеми свойствами кислот, однако она значительно слабее таких кислородсодержащих кислот, как серная и азотная.
В отличие от этих кислот фосфорная кислота не обладает также сколько-нибудь значительными окислительными свойствами (устойчивость с.о +5 у фосфора).
Качественная реакция на ортофосфат – ион
Na3PO4+3AgNO3=Ag3PO4+3NaNO3 – образует нерастворимое вещество желтого цвета
Вопрос 60. Оксиды углерода: получение, свойства.
Оксид углерода (II) СО (угарный газ)
В молекуле СО атомы кислорода и углерода
связаны двумя видами ковалентной связи:
ковалентной полярной и донорно-акцепторной.
Кислород является донором, углерод – акцептором
Получение
1. При неполном горении углерода
2С(к) + О2 = 2СО↑
2. При 400-5000С реакция между углем и диоксидом углерода
С(к) + СО2 = 2СО ↑
Физические свойства
Бесцветный газ, без запаха, очень мало растворим в воде,
чрезвычайно ядовит, особенно опасен тем, что не имеет запаха;
поэтому отравление им может произойти незаметно.
Химические свойства
Несолеобразующий оксид
1. Является энергичным восстановителем.
FeO + CO = Fe + CO2 используется в металлургии при получении металлов
2. При высокой температуре и давлении реагирует с гидроксидом натрия
CO + NaOH = HCOONa
3. Реагирует с хлором в присутствии угля с образованием фосгена
СО + Cl2 = COCl2
4.Оксид углерода (II) соединяется со многими металлами, образуя карбонuлы металлов
пентакарбонил железа Fe(CO)5
тетракарбонил никеля Ni(CO)4
Вопрос 59. Общая характеристика IV А группы периодической системы Д. И. Менделеева. Углерод: аллотропия, свойства.
углерод 6 С кpeмний 14 Si германий 32 Ge
олово 50 Sn свинец 82 Pb
Строение внешнего энергетического уровня
в основном состоянии .... ns2np2
В возбужденном состоянии ....ns1np3
Возможные с. о. С и Si -4, -2, +2, +4
Металлы Ge, Sn и Pb проявляют только положительные с. о.
Формула высшего оксида RО2
летучего водородного соединения RН4
Аллотропия углерода: алмаз, графит, карбин, фуллерены.
Алмаз- бесцветное, прозрачное вещество,
чрезвычайно сильно преломляет лучи света, не проводит электрический ток.
Тип гибридизации - sр3
Кристаллическая решетка алмаза – тетраэдр
Получают искусственным путем из графита
(давление 1010 Па, температура около 30000
При прокаливании в кислороде алмаз сгорает, образуя диоксид углерода. При сильном нагревании без доступа воздуха превращается в графит.
Графит - мягкое, темно-серое вещество со слабым металлическим блеском, электропроводник. Тип гибридизации - sр2
Кристаллическая решетка имеет слоистое строение. На воздухе графит не загорается даже при сильном накаливании,но легко сгорает в чистом кислороде, превращаясь в диоксид углерода.
Карбuн - черный мелкокристаллический порошок, полупроводник Тип гибридизации - sp
Состоит из углеродных фрагментов с тройной –С≡С–С≡С–, или двойной кумулированной
=С=С=С=С= связью.
Может быть линейным или образовывать циклические структуры. При сильном нагревании без доступа воздуха превращается в графит.
Фуллерены
Молекулы представляет собой замкнутые сфероидальные поверхности, содержащие 60, 70, 76, 84 и др. атомов углерода
Химические свойства углерода
Углерод является типичным неметаллом.
Углерод как восстановитель
1. Углерод горит на воздухе с выделением большого количества тепла С + О2 = СО2 + Q
При недостатке кислорода образуется оксид углерода (II) 2С + О2 = 2СО
2. Раскаленный углерод реагирует с парами серы,
легко соединяется с галогенами С + 2S = CS2
3. При пропускании через раскаленный уголь водяного пара получается водяной газ
С + Н2О = СО + Н2
4. Восстановление оксидов металлов CuO + C = Cu + CO
Углерод как окислитель
1. Под воздействием высоких температур взаимодействует с металлами
с образованием карбидов Са + 2С = СаС2
2. С водородом С + 2Н2 = СН4
Физические свойства : существует с аллотропными модификациями !
Вопрос 61. Угольная кислота и ее соли (карбонаты, гидрокарбонаты). Качественные реакции на карбонат – ион.
