Энергетика химических процессов
РОСЖЕЛДОР
Государственное образовательное учреждение
Высшего профессионального образования
«Ростовский государственный университет путей сообщения»
(РГУПС)
 |
ОБЩАЯ ХИМИЯ
Учебное пособие для студентов-заочников
Ростов-на-Дону
УДК 541: 378
 |
 Общая химия : учеб. пособие для студентов-заочников / В.М. Виленский (разд. 2, 5, 6, 8, 11), Ю.Ф. Мигаль разд. 1, 2, 3, 4), Л.Г. Тищенко (разд.1, 3, 4, 12), В.А. Февралева (разд. 8, 9, 10), С.А. Воляник (разд. 6), Г.П. Камышанская (разд. 12), Л.В. Мельникова ( разд. 7) ; Рост. гос. ун-т путей сообщения. – Ростов н/Д, 2009. – 79 с. Библиогр.: 9 назв.
Общая химия : учеб. пособие для студентов-заочников / В.М. Виленский (разд. 2, 5, 6, 8, 11), Ю.Ф. Мигаль разд. 1, 2, 3, 4), Л.Г. Тищенко (разд.1, 3, 4, 12), В.А. Февралева (разд. 8, 9, 10), С.А. Воляник (разд. 6), Г.П. Камышанская (разд. 12), Л.В. Мельникова ( разд. 7) ; Рост. гос. ун-т путей сообщения. – Ростов н/Д, 2009. – 79 с. Библиогр.: 9 назв.
Учебное пособие предназначено для самостоятельной работы студентов- заочников всех специальностей, изучающих дисциплину «Химия».
Пособие содержит сведения по основным разделам курса общей химии: «Химическая термодинамика», «Скорость химических реакций», «Химическое равновесие», «Строение вещества», «Растворы», «Окислительно-восстановительные реакции», «Электрохимия», «Жесткость воды». На конкретных примерах рассматривается методика решения типовых задач.
В последнем разделе пособия приводятся задачи прикладного характера, позволяющие студентам применить знания по различным разделам курса общей химии.
Рецензенты: д-р хим. наук, проф. В.В. Экилик (РГУ);
канд. физ.-мат. наук, доц. Н.Б. Шевченко (РГУПС)
ã Ростовский государственный университет
путей сообщения, 2009
ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
Наука о взаимных превращениях различных видов энергии называется термодинамикой.
При химических реакциях происходят глубокие качественные изменения в системе: рвутся связи в исходных веществах и возникают новые связи в конечных продуктах. Эти изменения сопровождаются поглощением или выделением энергии обычно в виде теплоты.
Раздел термодинамики, изучающий тепловые эффекты химических реакций, называется термохимией.
При любом процессе выполняется первое начало термодинамики: теплота Q, поглощенная системой, идет на изменение её внутренней энергии DU и на совершение работы А:
Q = DU + A. (1)
Напомним, что внутренняя энергия характеризует кинетическую и потенциальную энергию всех частиц вещества, которая может изменяться при физических и химических процессах.
Тепловым эффектом реакции называется количество выделенного или поглощенного тепла. Стандартный тепловой эффект соответствует стандартным условиям проведения реакций: Т = 298,15 К, р = 101,3 кПа. Тепловой эффект реакции, протекающей при постоянном объеме системы, равен изменению внутренней энергии:
QV = DU. (2)
Большинство химических реакций протекает при постоянном давлении. Тепловой эффект химической реакции, протекающей при постоянном давлении, равен изменению энтальпии:
Qр= DН. (3)
Энтальпия равна сумме внутренней энергии и произведения давления на объем:
Н = U + pV. (4)
Другое определение энтальпии – теплосодержание системы.
Реакции, которые сопровождаются выделением теплоты, называются экзотермическими. При их протекании теплосодержание системы уменьшается (DН < 0).
При протекании же эндотермических реакций, идущих с поглощением тепла, теплосодержание увеличивается (DН > 0).
В зависимости от характера происходящего процесса различают теплоты образования, сгорания, растворения и т.д. Понятие о теплоте образования вещества является одним из важнейших в термохимии.
Напомним, что теплотой образования (DНобр) называют тепловой эффект реакции образования одного моля сложного вещества из простых, устойчивых при стандартных условиях (Т = 298,15 К, р = 101,3 кПа). Теплоты образования веществ приведены в табл. 1. Теплоты образования простых веществ, устойчивых при стандартных условиях, приняты равными нулю.
Таблица 1
| Вещество | DНобр, кДж/моль | Вещество | DНобр, кДж/моль |
| Al2O3 (T) Al2(SO4)3 (T) CH4 (Г) C2H6 (Г) C6H6 (Ж) CO (Г) CO2 (Г) COS (Г) HCl (Г) HNO3 (Ж) CuO(T) Cu(NO3)2 (T) H2O(Ж) | -1675 -3434 -75 -85 -110 -393 -137 -92 -173 -165 -307 -286 | H2O (Г) H2S (Г) MgO (T) Mg(NO3)2 (T) NO2 (Г) NaHCO3 (T) Na2CO3 (T) Na2S (T) Na2SO3 (T) Na2SO4 (T) POCl3 (Ж) PCl5 (T) SO2 (Г) | -242 -20 -601 -790 -914 -1129 -372 -1090 -1388 -597 -369 -297 |
Основным законом термохимии является закон Гесса: Тепловой эффект химической реакции зависит от природы и физического состояния исходных веществ и продуктов реакции и не зависит от пути её проведения. Тепловые эффекты зависят от многочисленных деталей строения реагирующих молекул, поэтому теоретически рассчитать их очень сложно. Закон Гесса позволяет на основании ограниченного количества опытных данных по теплотам образования вычислять тепловые эффекты большого числа реакций.
В соответствии с законом Гесса тепловой эффект ряда последовательных реакций равен тепловому эффекту другого ряда последовательных реакций, если исходные вещества и продукты превращений одинаковы. На основании этого подхода с термохимическими уравнениями можно оперировать так же, как и с алгебраическими. Термохимическими называются химические уравнения, в которых указаны тепловые эффекты реакций.
Пример 1. Вычислить стандартную теплоту образования оксида железа (III) по следующим термохимическим уравнениям:
1) 2Fe (т) + O2 (г) = 2FeO; DH1 = –532 кДж,
2) 4FeO (т) + O2 (г) = 2Fe2O3 (T); DH2 = –584 кДж.
Решение. Запишем термохимическое уравнение образования Fe2O3 из простых веществ:
3) 2Fe (T) + 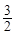 O2 = Fe2O3; DHх.р. = ?
O2 = Fe2O3; DHх.р. = ?
Для того чтобы из двух данных уравнений получить искомое уравнение (3), нужно уравнение (2) разделить на два и сложить с уравнением (1). Такие же алгебраические действия проведем с тепловыми эффектами данных реакций и получим искомую величину DHх.р.:
2Fe + 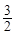 O2 = Fe2O3; DHx.р. =
O2 = Fe2O3; DHx.р. = 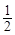 (-584) -532 = -824 кДж/моль.
(-584) -532 = -824 кДж/моль.
Для расчета тепловых эффектов химических реакций часто используют первое следствие из закона Гесса:
Тепловой эффект химической реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ:
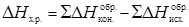 (5)
(5)
Пример 2. Рассчитайте тепловой эффект реакции горения этана, исходя из стандартных теплот образования. Какое количество теплоты выделится или поглотится, если: а) сгорает 90 г этана; б) образовалось 89,6 л CO2 (н.у.).
Решение. Запишем термохимическое уравнение реакции горения этана в расчете на 1 моль:
C2H6 (Г) + 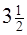 O2 = 2CO2 (Г) + 3H2O (Ж); DHх.р = ?
O2 = 2CO2 (Г) + 3H2O (Ж); DHх.р = ?
Рассчитаем тепловой эффект реакции по первому следствию из закона Гесса:
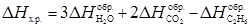
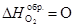 , т.к. это простое вещество.
, т.к. это простое вещество.
Подставим значения теплот образования из табл. 1:
DHх.р = 3 (–286) + 2(–393) + 85 = – 1559 кДж/моль.
Поскольку DHх.р <0, реакция экзотермическая.
По уравнению реакции сгорает 1 моль C2H6, т.е. 30 г. По условию задачи в реакцию вступило 90 г C2H6, что составляет:
n = 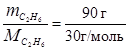 = 3 моля.
= 3 моля.
Тогда количество тепла, выделенного при сгорании 90 г этана, будет:
Q = n · DHх.р = 3 моля . (–1559 кДж/моль) = – 4677 кДж.
По уравнению реакции из одного моля этана образуется 2 моля CO2. Напомним, что моль газа при н.у. занимает объем 22,4 л/моль. По условию задачи образовалось 89,6 л CO2 , что составляет:
n = 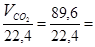 4 моля.
4 моля.
Количество тепла, выделяемое при этом, равно:
Q = n ·DHх.р = 4 моля · (-1559 кДж/моль) = - 6236 кДж.
Тепловой эффект химической реакции можно также вычислить, используя второе следствие из закона Гесса:
Тепловой эффект химической реакции равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания конечных веществ:
DHх.р = SDH 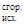 – SDH
– SDH 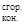 (6)
(6)
Теплотой сгорания вещества (DHсгор) называется тепловой эффект реакции окисления 1 моля вещества кислородом с образованием высших (устойчивых) оксидов. Для органических соединений теплотой сгорания называется тепловой эффект реакции полного сгорания 1 моля данного органического вещества с образованием CO2 и H2O. Стандартные теплоты сгорания приведены в табл. 2. Обратите внимание на то, что теплоты сгорания высших оксидов (H2O, CO2) равны нулю.
Таблица 2
| Вещество | DHсгор, кДж/моль |
| CO CH4 C2H2 C2H6 C2H5OH CH3COOH CH3COOC2H5 C2H3COOH H2 NH3 N2O | -283 -890 -1300 -1560 -1367 -874 -2254 -1370 -286 -383 -69 |
Пример 3. Рассчитайте тепловой эффект реакции этерификации исходя из стандартных теплот сгорания. Какое количество теплоты выделится или поглотится, если в реакцию вступило 138 г этанола?
Решение. Запишем термохимическое уравнение реакции:
C2H5OH (ж) + CH3COOH(ж) = CH3COOC2H5 (Ж) +H2O (Ж) ; DHх.р = ?
Тепловой эффект химической реакции рассчитаем по второму следствию из закона Гесса:
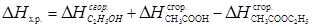
DH 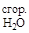 = 0, т.к. вода – это высший оксид.
= 0, т.к. вода – это высший оксид.
Подставим численные значения теплот сгорания из табл. 2:
DHх.р= -1367 -874 + 2254 = 13 кДж/моль,
т.к. DH > 0, реакция эндотермическая.
По уравнению реакции реагирует 1 моль C2H5OH. По условию задачи в реакцию вступило 138 г C2H5OH , что составляет:
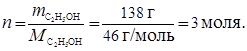
Тогда количество тепла, поглощенного в данной реакции:
Q = n . DHх.р = 3 моля . 13 кДж/моль = 39 кДж.
Следствия из закона Гесса применяются также при термохимических расчетах для определения теплот образования или сгорания исходных веществ или продуктов реакции.
Пример 4. Вычислите стандартную теплоту образования бензола на основании термохимического уравнения реакции его сгорания:
C6H6 (ж) +7 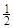 O2 = 6 CO2 (г) + 3H2O(г) ; DHх.р = –3133 кДж/моль.
O2 = 6 CO2 (г) + 3H2O(г) ; DHх.р = –3133 кДж/моль.
Решение. По первому следствию из закона Гесса:
DHх.р = 6 DH 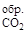 + 3 DH
+ 3 DH 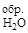 – DH
– DH 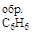 ;
;
DH 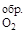 = 0, т.к. это простое вещество.
= 0, т.к. это простое вещество.
Выразим отсюда теплоту образования бензола:
DH 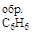 =
= 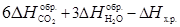 .
.
Подставим численные значения из табл. 1:
DH 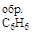 = 6 (-393) + 3 (-242) + 3133 = 49 кДж/моль.
= 6 (-393) + 3 (-242) + 3133 = 49 кДж/моль.
Пример 5. Вычислите стандартную теплоту сгорания ацетилена C2H2 на основании термохимического уравнения:
C2H2 (г) + CO(г) + H2O(ж) = C2H3COOH; DHх.р = –213 кДж/моль.
акриловая
кислота
Решение. По второму следствию из закона Гесса:
DHх.р = DH 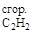 + DH
+ DH 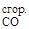 + DH
+ DH 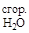 – DH
– DH 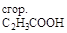
Отсюда выразим теплоту сгорания ацетилена:
DH 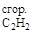 = DHх.р – DH
= DHх.р – DH 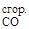 – DH
– DH 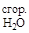 +DH
+DH 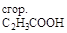
Подставив численные значения из табл. 2, найдем теплоту сгорания ацетилена:
DH 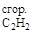 = –213 + 283 -1370 = –1300 кДж/моль.
= –213 + 283 -1370 = –1300 кДж/моль.
ЗАДАЧИ
1-5. Вычислите теплоту образования подчёркнутого в уравнении вещества, исходя из термохимических уравнений.
| № задачи | Уравнение реакции | DHх.р, кДж | Ответы DHобр., кДж/моль |
| 1) 4NH3 + 5O2 = 4NO + 6H2O(ж) 2) 4NH3 + 3O2 = 2N2 + 6H2O(ж) | -1169 -1530 | ||
| 1) 4As +3O2 = 2As2O3 2) As2O3 + O2 = As2O5 | -1328 -261 | -925 | |
| 1) CuCl2 + Cu = 2CuCl 2) Cu + Cl2 = CuCl2 | -56 -216 | -136 | |
| 1) 2P + 3Cl2 = 2PCl3 2) PCl5 = PCl3 + Cl2 | -574 | -375 | |
| 1) 2Pb + O2 = 2PbO 2) 2PbO2 = 2PbO + O2 | -438 | -277 |
6-10. Рассчитайте тепловой эффект указанной реакции, исходя из стандартных теплот образования (табл. 1). Вычислите также количество теплоты (Q), которое выделится или поглотится, если в данную реакцию вступило m г первого вещества.
| № задачи | Уравнение реакции | m, г | Ответы Q, кДж |
| H2S(г) + CO2(г) = H2O (г)+ COS (г) | |||
| S(т) + 2CO2(г) = SO2(г) + 2CO(г) | |||
| CO2(г) + 4H2(г) = CH4(г) + 2H2O(г) | -332 | ||
| PCl5(т) + H2O(г) = POCl3(ж) + 2HCl(г) | -680 | ||
| 2NaHCO3 (т)= Na2CO3 (т) + H2O(г) + CO2(г) |
11-15. Вычислите тепловой эффект указанной реакции, исходя из стандартных теплот сгорания (табл. 2). Рассчитайте количество теплоты, которое выделится или поглотится, если в данную реакцию вступило V литров первого газа.
| № задачи | Уравнение реакции | V, л | Ответы Q, кДж |
| 2СН4(Г) + О2(Г) = 2СО(Г) + 4Н2(Г) | 89,6 | -140 | |
| 2NH3(Г) + 2О2(Г) = N2O(Г) + 3H2O(Г) | 67,2 | -1045,5 | |
| С2Н2(Г) +2СО2(Г) = 4СО(Г) + Н2(Г) | |||
| СН4(Г) + СО2(Г) = 2СО(Г) + 2Н2(Г) | 44,8 | ||
| С2Н6(Г) + Н2(Г) = 2СН4(Г) | -165 |
16-20. Рассчитайте стандартную теплоту образования первого в уравнении вещества, исходя из приведенного термохимического уравнения реакции и данных по DНобр. (табл. 1).
| № задачи | Уравнение реакции | DНх.р.,кДж/моль |
| 2Аl2О3(Т) + 6SО2(г) +3О2 = 2Аl2(SО4)3(т) | -1736 | |
| 4NО2(г) + О2 + 2Н2О(ж) = 4НNО3(ж) | -252 | |
| 2Мg(NО3)2(т) = 2МgО(т) + 4NО2(г) + О2 | ||
| 2СuО(т) + 4NО2(г) + О2 = 2Сu(NО3)2(т) | -416 | |
| 4Na2SO3 (т) = 3Na2SO4 (т) + Nа2S(т) | -176 |
