Скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени.
Различают среднюю скорость
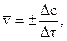 (4.1)
(4.1)
где Δс=с2-с1 – изменение концентрации вещества за промежуток времени Δτ=τ2-τ1. Знак (+) означает, что вещество образуется, а знак ( – ) – что вещество расходуется в ходе реакции.
Истинная (мгновенная) скорость реакции определяется соотношением
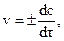 (4.2)
(4.2)
где dc – бесконечно малое изменение концентрации вещества за бесконечно малый промежуток времени dτ.
Основными факторами, определяющими скорость реакции, являются природа реагирующих веществ, концентрация, температура и катализатор. Скорость реакций с участием газообразных реагентов зависит также от давления.
Зависимость скорости реакции от концентрации. Все химические реакции можно разделить на гомогенные и гетерогенные. К гомогенным реакциям относятся реакции, протекающие между веществами, находящимися в одном агрегатном состоянии, если между ними отсутствуют поверхности раздела. К гомогенным реакциям относятся реакции между газами, неограниченно смешивающимися жидкостями и жидкими растворами. Гомогенные реакции протекают в объеме, т.е. имеются наиболее благоприятные условия для контакта молекул реагирующих веществ.
Реакции между веществами, находящимися в разных агрегатных состояниях или в одном агрегатном состоянии, но разделенными поверхностями раздела, относятся к гетерогенным реакциям. К ним относятся, например, реакции между газом и жидкостью, двумя несмешивающимися жидкостями, механическими смесями твердых веществ. В гетерогенных реакциях химический процесс протекает только на поверхностях раздела реагирующих фаз.
Зависимость скорости гомогенной реакции от концентрации определяется законом действующих масс (закон Гульдберга и Вааге, закон действия масс): скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов.
Для обратимой гомогенной химической реакции, записанной в общем виде,
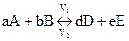 (4.3)
(4.3)
скорость прямой реакции
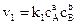 , (4.4)
, (4.4)
скорость обратной реакции
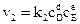 , (4.5)
, (4.5)
Где 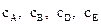 – концентрации реагирующих веществ, моль/л; a, b, d, e – стехиометрические коэффициенты, или порядок реакции по реагенту A, B, D или E; k1 и k2 – константы скоростей химических реакций.
– концентрации реагирующих веществ, моль/л; a, b, d, e – стехиометрические коэффициенты, или порядок реакции по реагенту A, B, D или E; k1 и k2 – константы скоростей химических реакций.
Константа скорости химической реакции k зависит от температуры и природы реагирующих веществ, но не зависит от их концентрации. Если концентрации реагирующих веществ равны единице, то константа скорости численно равна скорости химической реакции.
Уравнения (4.4) и (4.5) называются кинетическими уравнениями химических реакций.
Скорость гетерогенных реакций не зависит от объемной концентрации реагирующих веществ, т.к. реакция протекает только на поверхности раздела фаз. Чем выше степень измельчения веществ, тем больше их поверхность и тем выше скорость протекания реакций. Скорость гетерогенных реакций зависит также от скорости подвода реагирующих веществ к поверхности раздела фаз и от скорости отвода продуктов реакции. Поэтому перемешивание реакционной смеси ускоряет протекание гетерогенной реакции.
Концентрации газообразных веществ могут быть выражены через парциальные давления. Парциальное давление газа в смеси равно тому давлению, которое производил бы газ, если бы он занимал объем всей смеси при тех же условиях. Парциальное давление i-го компонента газовой смеси ( 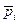 ) может быть рассчитано по формуле
) может быть рассчитано по формуле
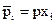 , (4.6)
, (4.6)
где 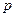
 – общее давление смеси; xi – объемная или молярная доля i-го компонента в смеси.
– общее давление смеси; xi – объемная или молярная доля i-го компонента в смеси.
Общее давление смеси газов равно сумме парциальных давлений компонентов:
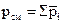 . (4.7)
. (4.7)
Для прямой реакции (4.3), если вещества А и В находятся в газообразном состоянии, выражение для скорости реакции запишется следующим образом:
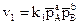 , (4.8)
, (4.8)
где 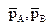 – парциальные давления веществ А и В.
– парциальные давления веществ А и В.
При изменении общего давления в n раз во столько же раз изменяется и парциальное давление каждого компонента и соответственно изменяется скорость реакции.
Пример 4.1.Написать выражения закона действующих масс для реакций:
а) 2NO(г) + Cl2(г) ® 2NOCl(г);
б) СаСО3(к) ® СаО(к) + СО2(г).
Решение. а) для прямой реакции 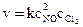 и для обратной –
и для обратной – 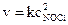 ;
;
б) прямая реакция: карбонат кальция – твердое вещество, присутствие которого не влияет на скорость реакции, искомое выражение будет иметь вид 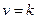 , т.е. в данном случае скорость реакции при определенной температуре постоянна; обратная реакция:
, т.е. в данном случае скорость реакции при определенной температуре постоянна; обратная реакция: 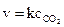 .
.
Пример 4.2.Во сколько раз следует увеличить концентрацию оксида углерода (II) в системе СО(г) + Н2О(г) ↔ СО2(г) + +Н2(г), чтобы скорость прямой реакции увеличилась в 5 раз?
Решение. Запишем выражение для скорости прямой реакции:
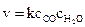 .
.
Пусть начальная концентрация СО – 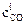 , а конечная –
, а конечная – 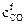 . Запишем отношение скоростей прямой реакции:
. Запишем отношение скоростей прямой реакции:
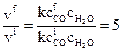 , откуда следует, что
, откуда следует, что 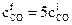 , т.е.
, т.е.
для увеличения скорости прямой реакции в 5 раз концентрацию СО следует увеличить также в 5 раз.
Пример 4.3.Определить, как изменится скорость прямой реакции 2SO2 + O2 ↔ 2SO3, если общее давление в системе увеличить в 4 раза.
Решение. Увеличение давления в системе в 4 раза вызовет уменьшение объема системы в 4 раза, а концентрации реагирующих веществ возрастут в 4 раза.
Согласно закону действующих масс начальная скорость прямой реакции
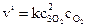 .
.
После увеличения давления
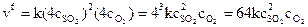 .
.
После увеличения давления в 4 раза скорость реакции возросла в 64 раза.
Порядок реакции. Сумма показателей степеней при концентрациях или парциальных давлениях в кинетических уравнениях реакций называется порядком реакции. Для прямой реакции
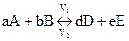
порядок равен а+b, а для обратной – d+e. Эта величина характеризует тип зависимости скорости реакции от концентрации. Порядок реакции обычно нельзя определить теоретически по виду химического уравнения. Это связано с тем, что подавляющее большинство реакций являются сложными, т.е. они протекают через некоторое число промежуточных стадий (истинный механизм реакции), которые чаще всего неизвестны. Порядок каждой из промежуточных стадий может отличаться от порядка реакции, определяемого из уравнения (формальный порядок реакции), т.к. в уравнении приводятся обычно только исходные вещества и конечные продукты реакции (суммарный или глобальный механизм).
По этой причине истинный порядок химической реакции и порядок реакции по каждому реагенту определяют экспериментально. Истинный порядок реакции в отличие от формального может быть как целым, так и дробным и даже нулевым. Реакции с порядком выше трех неизвестны.
