Кислородсодержащие соединения
Введение.
Нефть состоит в основном из углеводородов, однако в небольших количествах в ней содержатся также их гетероатомные производные – кислород, серо- и азотсодержащие соединения.
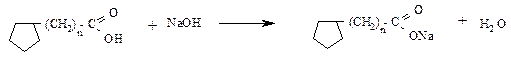
Содержание кислорода в нефтях невелико (0,1-2 %). Нефтяные кислоты (алифатические R-COOH, ароматические 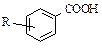 , нафтеновые
, нафтеновые 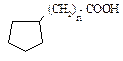 ) и фенолы
) и фенолы 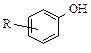 .
.
Значительное количество кислорода содержится в смолистых веществах (асфальтеновые кислоты). Кислород входит также в состав смолистых веществ, а именно асфальтогеновых кислот.
Из-за жестких условий залегания в них практически отсутствуют также химически активные кислородсодержащие соединения, как спирты и альдегиды. Кетоны и эфиры (сложные и простые) встречаются в нефтях в следовых количествах.
Целью данной лабораторной работы является ознакомление с физическими и химическими свойствами основных кислородсодержащих соединений – спиртов, фенолов, альдегидов и карбоновых кислот.
Порядок выполнения работы.
Опыт 1. Растворимость фенола в воде.
В пробирку помещают шпателем ~1г фенола и добавляют ~ 4-5 мл воды. Отмечают, что фенол плохо растворяется даже при встряхивании.
Разливают суспензию в три пробирки. Одну из пробирок нагревают и отмечают полное растворение фенола.
Опыт 2. Цветная реакция на фенол.
После остывания первой пробирки в нее добавляют 1 каплю раствора хлорного железа. Наблюдают появление фиолетового окрашивания, вызванного образованием комплексного соединения.
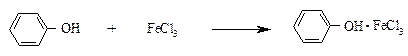
Опыт 3. Получение фенолята натрия.
К суспензии фенола, содержащейся во второй пробирке, прибавляют раствор гидроксида натрия. Образуется прозрачный раствор вследствие получения водорастворимого фенолята натрия.
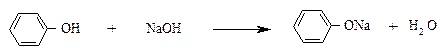
К полученному прозрачному раствору добавляют по каплям разбавленный раствор серной кислоты – появляется эмульсия из-за выделения исходного фенола.
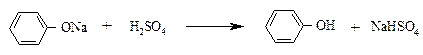
Опыт 4. Получение трибромфенола.
В третью пробирку с водной эмульсией фенола добавляют по каплям при постоянном перемешивании бромную воду. Образуется хлопьевидный осадок 2,4,6-трибромфенола.
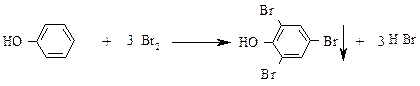
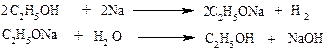
Опыт 5. Образование и гидролиз алкоголятов.
В сухую пробирку помещают маленький кусочек металлического натрия. Добавляют 3 мл этилового спирта и закрывают пробирку пробкой с газоотводной трубкой. Подносят конец газоотводной трубки к пламени горелки. У отверстия газоотводной трубки воспламеняется выделяющий водород. Оставшийся на дне пробирки беловатый остаток этилата натрия растворяют в 2-3 мл дистиллированной воды, добавляют 1 каплю спиртового раствора фенолфталеина – появляется малиновое окрашивание.
Опыт 6. Окисление альдегидов соединениями серебра (реакция серебрянного зеркала).
Предварительно готовят аммиачный раствор окиси серебра, добавляя к 4-5 мл раствора нитрата серебра разбавленный водный раствор аммиака до растворения осадка. К раствору формальдегида приливают 1 мл свежеприготовленного аммиачного раствора окиси серебра и добавляют 2-3 капли разбавленного раствора щелочи. Пробирку встряхивают и ставят в штатив.
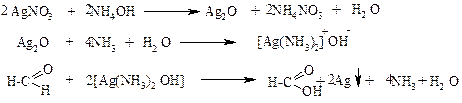
Опыт 7. Растворимость в воде различных кислот.
В три пробирки помещают небольшое количество уксусной (СН3СООН), бензойной (С6Н5СООН) и смесь нафтеновых кислот. В каждую пробирку добавляют по 3-4 мл воды. Наблюдают быстрое растворение уксусной кислоты. Бензойная и нафтеновые кислоты при комнатной температуре растворяются плохо. При нагревании эти кислоты растворяются, а при охлаждении вновь образуются их водные эмульсии.
Опыт 8. Взаимодействие уксусной кислоты с магнием.
В пробирку наливают 2-3 мл уксусной кислоты и помещают туда же немного металлического магния. Наблюдают выделение пузырьков водорода.
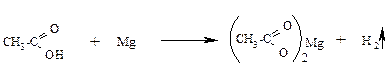
Опыт 9. Взаимодействие кислот со щелочами и содой.
а) К содержимому пробирки с водной суспензией бензойной кислоты из опыта 7 добавляют раствор едкого натрия, встряхивают. Наблюдают растворение бензойной кислоты.
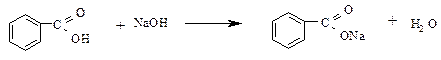
К полученному прозрачному раствору натриевой соли бензойной кислоты добавляют несколько капель раствора соляной кислоты. Наблюдают вновь образование хлопьев бензойной кислоты.
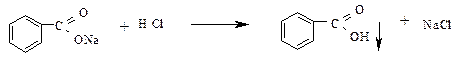
б) К пробирке с водной эмульсией нафтеновых кислот из опыта 7 приливают раствор щелочи. Встряхивают обе пробирки и также наблюдают образование прозрачных растворов вследствие получения водорастворимых солей.
Содержимое пробирки с щелочным раствором нафтеновых кислот взбалтывают и наблюдают образование пены. Это свидетельствует о том, что соли нафтеновых кислот обладают поверхностно - активными моющими свойствами. Они используются в промышленности под названием мылонафт.
Опыт 10. Определение кислотного числа нефтепродукта.
Количественное определение нафтеновых кислот в нефтяных фракциях осуществляется методом кислотных чисел.
Кислотным числом называется количество миллиграммов КОН, необходимое для нейтрализации 1г вещества. Кислотное число определяется титрованием навески нефтепродукта методом объемно-метрического титрования в присутствии индикатора – фенолфталеина.
Небольшую коническую колбу взвешивают на аналитических весах с точностью до 0,0002 г. Добавляют в неё 2-3 капли нефтепродукта (0,03-0,05г) и вновь взвешивают нефтепродукт.
Растворяют навеску в 20 мл спиртобензольной смеси. Затем титруют 0,1 N раствором КОН в присутствии фенолфталеина (1-2 капли) до слабо-розового окрашивания.
Кислотное число рассчитывается по формуле:
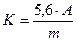
где К – кислотное число, мг КОН/1г вещества,
m – навеска нефтепродукта в г,
А – количество миллилитров 0,1N раствора КОН,
5,6 – количество миллиграммов КОН в 1 мл 0,1N раствора КОН.
Молекулярную массу исследуемой кислоты можно рассчитать следующим образом:
M=56∙1000/К
Контрольные вопросы
1. В одну пробирку поместим раствор фенола, в другую – масляную (бутановую) кислоту. Как определить, в какой пробирке находится фенол, а в какой кислота?
2. Как разделить бензольный раствор смеси фенола и уксусной кислоты?
3. Может ли быть получен с участием фенола (как одного из компонентов) сложный эфир? Если да, приведите пример реакции
4. Что такое «кислотное число»? На какой реакции основано его определение? Приведите схему реакции.
5. Как меняется окраска раствора в присутствии фенолфталеина в зависимости от рН среды?
