Порядок расположения материалов в библиографическом списке
-Научная литература в алфавите авторов и заглавий документов
-Монографии
-Комментарии
-Сборники научных трудов
-Научные статьи из специализированных журналов и сборников
-Диссертации, авторефераты диссертаций, научные отчёты
-Обзорная литература
-Документы практической деятельности организаций, предприятий, включая архивные документы, собранные по хронологии.
Пример расположения источников в списке использованной литературы :
1.Солнцев Ю. П. Специальные материалы в машиностроении: учебник для вузов / Ю. П. Солнцев, Е. И. Пряхин, В. Ю. Пирайнен; под ред. Ю. П. Солнцева. - СПб.: Химиздат, 2004, 640 с.
2 Семенова И. В. Коррозия и защита от коррозии: учеб. пособие / И. В. Семенова, Г. М. Флорианович, А. В. Хорошилов ; под ред. И. В. Семеновой. - М.: Физматлит, 2002, 334 с.
ЗАДАНИЕ К СЕМЕСТРОВОЙ РАБОТЕ
ДЛЯ СТУДЕНТОВ ОЧНОЙ ФОРМЫ ОБУЧЕНИЯ
Таблица 1. Варианты заданий к семестровой работе
| Задание вариант | 1 вопрос | 2 вопрос | 3 вопрос | вопрос (задача) | Сообщение и презентация |
ВОПРОСЫ К СЕМЕСТРОВОЙ РАБОТЕ. ЧАСТЬ 1.
- Причины возникновения межкристаллитной коррозии сталей?
- Что такое «поляризационная диаграмма»? Способы изображения диаграмм.
- Чем вызывается питтинговая коррозия металлов? Причины возникновения.
- Дайте коррозионную характеристику меди и сплавам с ее содержанием.
- Консервация приборов, машин, механизмов, металлоконструкций,.
- Как зависит назначение металлоизделий на условие хранения?
- Как перейти от массовых показателей коррозии к глубинному?
- Какие условие сплошности пленки при высокотемпературном окислении металлов.
- Как классифицируются стали в зависимости от содержания хрома?
- В каких средах неустойчивы материалы на основе диоксида кремния?
- Термодинамическое условие возникновения электрохимической коррозии?
- Какие показатели используют при оценке газовой коррозии?
- Правило Таммана. Суть.
- Что дает легирование хромистых сталей молибденом?
- Дайте коррозионную характеристику алюминия.
- Что такое « перенапряжение водорода»?
- Укажите условия, при которых протекает газовая коррозия.
- Что называется жаропрочностью и жаростойкостью металла?
- Приведите определение химического механизма коррозии. При каких условиях он реализуется в газовой фазе.
- Коррозия под действием блуждающих токов. Методы защиты
- 12. Пассивация металлов. Теория пассивации.
- Методы коррозионных исследований. Показатели скорости коррозии
- Какие особые случаи протекания газовой коррозии вы знаете?
- В чем состоит сутькинетики газовой коррозии?
- Какое условие образования сплошной оксидной пленки на металле должно выполняться?
- Состав сплавов типа «нихром», области применения сплав?
- Дайте коррозионную характеристику свинца и сплавам с его содержанием.
- Что такое «поляризационные сопротивления»? роль
- Что такое «перенапряжение кислорода»?
- Атмосферная коррозия. Общая характеристика. Факторы. Методы защиты
- Что дает введение в хромоникель и молибденовые сплавы меди в качестве легирующего элемента?
- Металлические защитные покрытия
- Металлические защитные покрытия. Методы нанесения металлических защитных покрытий.
- Неметаллические защитные покрытия: лакокрасочные, эмалевые
- Напишите уравнение Нернста и укажите, в каких случаях оно применимо?
- Дайте коррозионную характеристику железа и железоуглеродистых сплавов.
- Полимерные и металлполимерные покрытия
- Какие факторы способствуют наступлению пассивного состояния металлов?
- Морская коррозия. Общая характеристика. Факторы. Методы защиты
- Дайте коррозионную характеристику титана и его сплавов.
- Перечислите методы защиты металлов от коррозии.
- Коррозия под действием блуждающих токов. Методы защиты.
- В чем различие между электрохимической и химической коррозией?
- Анодная защита от внешнего источника тока.
- Коррозия с кислородной деполяризацией.
- Как образуется двойной электрический слой? Опишите его строение.
- На основании, каких термодинамических величин можно сделать заключение о возможности протекания коррозии?
- Что представляют собой диаграммы Пурбе?
- Что называется контцентрационной поляризацией? Приведите основные уравнения.
- Назовите характерные признаки питтинговой коррозии.
- что такое ржавчина? Обладает ли она защитными свойствами
- Какие сплавы называются сталями?
- Охарактеризуйте коррозионные свойства железа и низколегированных сталей в минеральных и органических средах
- Добавки каких элементов повышают коррозионные свойства сталей?
- Охарактеризуйте электрохимические свойства алюминия
- Методы удаления окислителя из коррозионной среды.?
- Укажите основные сплавы на основе никеля и область их применения.
- Приведите основные электрохимические и коррозионные характеристики цинка. Укажите область применения.
- Перечислите способы защиты от питтинговой коррозии.
- Охарактеризуйте основные особенности протекания межкристаллитной коррозии.
- Какие существуют методы испытания нержавеющих сталей и их сварных соединений?
- Защита металлов от газовой коррозии.
- В каких условиях протекают ножевая и избирательная коррозия.
- Что такое коррозионное растрескивание и коррозионная усталость?
- Нарушение пассивного состояния: виды и какими факторами они вызываются?
- Перечислите внешние факторы, оказывающие существенное влияние на кинетику электрохимической коррозии.
- Запишите условие сплошности пленки при высокотемпературном окислении металлов.
- Принцип протекторной защиты (схема).
- Какими факторами обуславливается коррозионное растрескивание высоколегированных хромистых сталей?
- Какие стадии определяют скорость процесса химической коррозии металлов в неэлектролитах?
- Какие вещества сообщают высокую коррозионную активность нефти?
- Из каких стадий складывается разрушение металлов в жидких металлах?
- Введение каких ингибиторов замедляет кристаллизацию растворенного металла в условиях термического переноса массы?
- В чем состоит борьба с химической коррозией металлоконструкций в жидких неэлектролитах?
- Чем характеризуется пассивация металлов? Каковы закономерности поведения металла в пассивном состоянии.
- Можно ли и до каких температур применять углеродистые стали в газовых средах?
- Что такое «перенапряжение водорода», по какому уравнению его можно рассчитать?
- В каких условиях целесообразно применять ингибиторы коррозии?
- Какими уравнениями описывается кинетика высокотемпературного окисления металлов?
- В чем сущность защита металлов от коррозии покрытиями.
- Какие существуют способы нанесения защитных покрытии?
- Приведите классификацию ингибиторам
- Как происходит защита металлов от коррозии с помощью ингибиторов.
- Как влияют конструкционные особенности элементов машин, аппаратов и сооружений на коррозионный процесс?
- Что учитывают при конструктивном оформлении оборудования?
- Чем опасны застойные зоны металлоконструкций?
- Дайте коррозионную характеристику благородных металлов (в каких условиях они могут корродировать?).
- Воспроизведите поляризационную диаграмму для металла, корродирующего с анодным контролем?
- Чем отличается коррозия железа в кислой среде от коррозии железа в нейтральной среде.
2.3. Задание к семестровой работе
часть 2
Задание №1
Рассчитать отрицательный и положительный массовый Кm±, глубинный Kп, и объемный Кv показателикоррозии металлов по данным табл. 3.2. Атмосферное давление во всех случаях равно 105 Па.
Таблица.2 - Данные для расчета показателей скорости коррозии
| № п/п | Металл | S, см2 | t, час. | Состав продуктов окисления | Dm, г | Объем поглощенного кислорода Vt, л | Температура окисления, К |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Mn | MnO | - | 2,5 | ||||
| Cr | Cr2O3 | - | |||||
| Ni | NiO | +20,0 | - | ||||
| Cu | CuO | -30,0 | - | ||||
| Mo | Mo2O3 | -40,0 | - | ||||
| Zn | ZnO | +20,0 | - | ||||
| Ni | NiO | - | 2,0 | ||||
| Fe | Fe2O3 | - | 0,5 | ||||
| Cd | CdO | - | 5,0 | ||||
| Co | CoO | - | 2,0 | ||||
| Fe | Fe3O4 | -0,1 | - | ||||
| Ni | NiO | -3,0 | - | ||||
| Mg | Mg | +10,0 | - | ||||
| V | V2O5 | -4,0 | - | ||||
| V | V2O4 | -10,0 | - | ||||
| Fe | Fe2O3 | 2,5 | |||||
| W | WO2 | ||||||
| W | WO3 | ||||||
| Bi | Bi2O3 | +75,5 | - | ||||
| Al | Al2O3 | +30,0 | - |
Задание №2
Оценить сплошность пленок, образуемых на поверхности металлов при высокотемпературной коррозии.
Таблица 3. - Данные для расчета условия сплошности пленок
| № п/п | Металл | Оксид | r , г/см3 | №п/п | Металл | Оксид | r , г/см3 | ||
| металл | оксид | металл | оксид | ||||||
| Al | Al2O3 | 2,70 | 4,00 | Mn | Mn3O4 | 7,30 | 4,80 | ||
| Be | BeO | 1,85 | 3,00 | Mn | Mn2O3 | 7,30 | 4,30 | ||
| Cd | CdO | 8,64 | 8,15 | Mo | MoO2 | 10,23 | 6,47 | ||
| Co | CoO | 8,80 | 6,20 | Mo | MoO3 | 10,23 | 4,6 | ||
| Co | Co2O3 | 8,80 | 5,18 | Nb | Nb2O5 | 8,56 | 4,7 | ||
| Co | Co3O4 | 8,80 | 6,10 | Nb | NbO2 | 8,56 | 5,98 | ||
| Cr | Cr2O3 | 7,16 | 5,21 | Nb | NbO | 8,56 | 7,26 | ||
| Cu | Cu2O | 8,93 | 6,0 | Ni | NiO | 8,90 | 7,45 | ||
| Cu | CuO | 8,93 | 6,4 | Pb | PbO2 | 11,34 | 9,38 | ||
| Fe | FeO | 7,86 | 5,7 | Pb | PbO | 11,34 | 9,53 | ||
| Fe | Fe3O4 | 7,86 | 5,1 | Ir | IrO2 | 22,42 | 3,15 | ||
| Fe | Fe2O3 | 7,86 | 5,24 | Sn | SnO | 7,3 | 6,45 | ||
| Mg | MgO | 1,74 | 3,58 | Ta | Ta2O5 | 16,6 | 8,74 | ||
| Mn | MnO | 7,30 | 5,40 | Zn | ZnО | 7,14 | 5,6 | ||
| V | VO | 6,11 | 5,7 | Zr | ZrO2 | 6,50 | 5,73 | ||
| V | V2O3 | 6,11 | 4,85 | Ca | CaO | 1,54 | 3,37 | ||
| V | V2O4 | 6,11 | 4,3 | Na | Na2O | 0,97 | 2,8 | ||
| V | V2O5 | 6,11 | 3,36 | Sr | SrO | 2,67 | 4,7 | ||
| W | WO2 | 19,3 | 12,11 | Ba | BaO | 3,50 | 5,0 | ||
| W | WO3 | 19,3 | 7,16 | Ti | TiO2 | 4,54 | 4,26 | ||
| W | W3O | 19,3 | 14,8 | Pb | Pb3O4 | 11,34 | 9,10 | ||
| Вi | Вi 2O3 | 9,87 | 8,93 | Ag | Ag2O | 10,5 | 7,14 | ||
| Sb | Sb2O3 | 6,67 | 5,67 | Pd | PdO | 12,02 | 8,7 | ||
| Ga | Ga2O3 | 5,9 | 5,95 | Pt | PtO | 21,45 | 14,9 | ||
| In | In 2O3 | 7,31 | 7,18 | Os | OsO2 | 22,4 | 11,37 |
Задание №3
Выбрать и обосновать наиболее экономически целесообразный способ защиты металлического изделия от коррозии в заданных условиях.
Таблица 4. Условия эксплуатации металлических материалов
| № | Изделие | Условие эксплуатации |
| 1 | 2 | 3 |
| Свая | Морская вода | |
| Конструкции буровой вышки | Морская атмосфера и вода | |
| Корпус корабля | Морская атмосфера и вода | |
| Канат | Подземная шахта | |
| Корпус вагонетки | Атмосферная коррозия | |
| Нефтехранилище (внутренняя поверхность) | Сырая нефть | |
| Мостовой кран | Отделение травления | |
| Мостовой кран | Цех прокатки | |
| Кран для погрузки | Шихтовый двор | |
| Кран для воды | Воздух | |
| Парогенератор | Перегретый пар, t= 300-500оС | |
| Водопроводные трубы | Горячая вода | |
| Водопроводные трубы | Холодная вода | |
| Травильная ванна | Серная кислота, 20% | |
| Травильная ванна | Соляная кислота, 15% | |
| Травильная ванна | Азотная кислота, 10% | |
| Гайка | Атмосфера | |
| Болт | Морская вода | |
| Подкрылки автомобиля | Атмосфера городская, гололед | |
| Подвесной мост | Территория промышленного предприятия | |
| Цельнометаллический вагон | Атмосфера | |
| Кузов автомобиля | Атмосфера, вода |
2.4. РЕКОМЕНДАЦИИ К РЕШЕНИЮ ЗАДАЧ СЕМЕСТРОВОЙ РАБОТЫ
Основными показателями коррозии металлов являются массовый показатель скорости коррозии Кm± , глубинный показатель Кп и объемный Кv.
Массовый показатель (Кm±) характеризует изменение массы (Dm) образца металла в результате коррозии, отнесенное к единице поверхности металла S и к единице времени t (например, г/м2×час, кг/ м2 ×с):

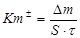 .
.
Этот показатель может быть отрицательным, если масса металла за время испытания t после удаления продуктов коррозии уменьшилась (-Dm). Он может быть и положительным, если масса образца за время испытаний увеличилась (+Dm) за счет образования оксидных пленок.
Если известен состав продуктов коррозии металла, то можно сделать пересчет положительного показателя изменения массы в отрицательный по формуле:

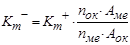
 ,
,
где Аме – атомная масса металла; Аок – атомная масса окислителя;nме –валентность металла; nок – валентность окислителя;Кm- и Кm+ – соответственно отрицательный и положительный массовый показатель коррозии.
Глубинный показатель Кп (мм/год) связан с массовым отрицательным (Кm-) следующей зависимостью:
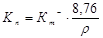 ,
,
где Кm- – отрицательный массовый показатель, г/м2×час; r – плотность корродирующего металла, г/см3; 8,76 – переводной коэффициент.
Объемный показатель коррозии определяется по формуле:
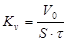 , где
, где
Vo – приведенный к нормальным условиям объем поглощенного газа, м3 и определяется по формуле:
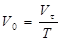 , где
, где
Т – температура окисления, К.
Во время высокотемпературного окисления из внешней среды поглощается кислород. Поэтому по изменению объема поглощенного кислорода можно рассчитать массу Dmпрокорродировавшего при этом металла, используя обычные стехиометрические расчеты.
Пример. При высокотемпературной коррозии цинка на воздухе в течение 5 часов поглотилось 200 см3 кислорода при 400 оС и нормальном давлении. Площадь изделия составляла 100 см2. Определить показатели скорости коррозии: Кm- , Кm+, Кп, Кv.
Поскольку объем кислорода Vt в ходе опыта дан при температуре 400оС, то его необходимо привести к нормальным условиям. Для этого целесообразно использовать следующую формулу:
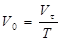 ,
, 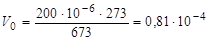 м3.
м3.
Объемный показатель коррозии определяем по формуле:
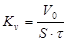
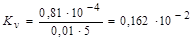 м3/м2× ч.
м3/м2× ч.
Высокотемпературное окисление цинка происходит по реакции:
2Zn + O2 = 2ZnO .
В соответствии с реакцией при высокотемпературном окислении двух грамм-атомов цинкарасходуется один грамм-моль кислородаили 22,4 л. При поглощении 200см3 кислорода вступает в реакцию следующее количество цинка:

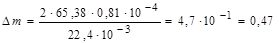 г.
г.
Определяем массовый отрицательный показатель скорости коррозии.
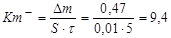 г/м2×час.
г/м2×час.
Определяем глубинный показатель скорости коррозии
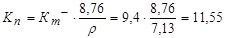 мм/год.
мм/год.
Пример 2. Оценить коррозионную стойкость меди на воздухе при высокой температуре. Медная пластина размером 50х60х3 мм после 15 суток окисления весила 80, 705г. Плотность меди 8,96г/см3.
Решение.Площадь поверхности пластины составляет:
S= 2∙ (50∙60) +2∙(50∙3)+2∙(60∙3)=6,66∙103мм2
Масса пластины до коррозии mн:
mн=V∙ρ=50∙60∙3∙8,96∙10−3=80,64г
Убыль массы пластины составляет:
Δm=m−mн=80,705-80,64=0,065г
Толщина слоя продукта коррозии после окисления в данных условиях:
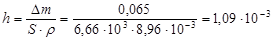 мм
мм
Следовательно, глубинный показатель коррозии составляет:
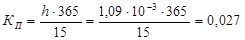 мм/год
мм/год
По глубинному показателю и десятибалльной шкале коррозионной стойкости металлов (табл. 3 Приложения) скорость коррозии находится в пределах 0,01-0,05мм/год, что составляет 4 балла и медь относится к стойким металлам.
Если по варианту задания дано положительное изменение массы металла (образовавшийся оксид формирует пленку на поверхности металла), то указанное число может быть использовано для расчета соответствующего положительного массового показателя. Для определения массы прореагировавшего металла (убыли массы) и объема поглощенного при окислении кислорода необходимо использовать стехиометрические соотношения реакции окисления. Полученные данные используют для расчета массового отрицательного и объемного показателей коррозии.
При окислении на поверхности металла образуются плёнки, которые снижают его химическую активность. Оксидные плёнки могут быть сплошные либо несплошные. Сплошность образуемой на металле оксидной пленки оценивают по неравенству:

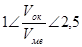 ,
,
где Vок –молекулярный объём оксида; Vме – атомный объём металла.
Соотношение условия сплошности можно рассчитать по формуле:
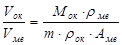 ,
,
где Мок – молекулярная масса оксида, rме – плотность металла, rок – плотность оксида, Аме – атомная масса металла, m – количество атомов металла в оксиде.
Если полученное расчетное значение 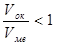 или
или 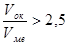 , то образованная оксидная пленка не является сплошной.
, то образованная оксидная пленка не является сплошной.
Необходимо обратить внимание на внутренние и внешние факторы газовой коррозии, защитные атмосферы, применяющиеся при нагреве изделий.
Приизучении теорий жаростойкого легирования необходимо усвоитьи уметь применять критерии, которыми руководствуются при выборелегирующего металла для защиты железа от высокотемпературной коррозии.
Согласно этим теориям к легирующим элементам можно предъявить следующие обобщенные требования:
· ионы легирующего компонента входят в решётку оксида основного металла,уменьшая его дефектность. Это можно достичь путем применения металлов, радиус ионов которых меньше радиуса иона железа: r*и < rи;
· легирующий компонент образует на поверхности свой защитный оксид,препятствующий окислению основного металла. Это достигается путем введения металлов, сродство к кислороду у которых выше, чем у железа, при этом оксид легирующего металла образуется быстрее. Это означает, что (DGт) Ме*m Оmn/2 < (DGт) Ме m Оmn/2 , где
· (DGт) Ме*m Оmn/2 - сродство к кислороду легирующего элемента;
· (DGт) Ме m Оmn/2 – сродство к кислороду железа;
· оксид легирующего элемента должен обладать защитными свойствами, т.е. удовлетворять условию сплошности;
· легирующий элемент должен образовывать оксид с высоким электрическим сопротивлением;
· легирующий компонент с основным металлом образует двойные оксиды типа шпинели, обладающие повышенными защитными свойствами;
· оксид легирующего компонента должен растворяться в основном металле;
· легирующий элемент должен образовывать оксид с высокой температурой плавления и возгонки.
