Вещества окислители-восстановители.
Вещества, содержащие атомы с промежуточными степенями окисления, могут в одних условиях проявлять окислительные свойства, в других условиях – восстановительные свойства, поэтому эти вещества принято выделять в группу окислителей-восстановителей. Например, сера в виде простого вещества проявляет окислительные свойства по отношению к металлам, давая сульфиды, к водороду, и восстановительные свойства к кислороду, хлору или азотистая кислота проявляет свойства восстановителя по отношению к более сильным окислителям (KMnO4, KClO3, K2Cr2O7) и свойства окислителя к восстановителям (H2S, HJ). В качестве примера можно привести реакции гидроксиламина
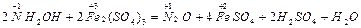


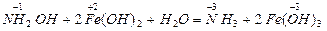
Классификация ОВР
Все ОВР по характеру изменения степени окисления атомов можно условно разделить на:
- реакции межмолекулярного окисления-восстановления;
- реакции диспропорционирования (самоокисления-
самовосстановления);
- реакции внутримолекулярного окисления-восстановления.
1. Реакции межмолекулярного окисления-восстановления
В них меняют степени окисления атомы, содержащиеся в разных веществах, например
Pb0 + 4HN+5O3(конц.) = Pb+2(NO3)2 + 2N +4O2 + 2H2O
2. Реакции диспропорционирования
В этих реакциях атомы одного и того же элемента с промежуточной степенью окисления, содержащиеся в одном и том же веществе, меняют свою степень окисления, понижая и повышая её, например
3K2Mn+6O4 + 2H2O = KMn+7O4 + Mn+4O2 + 4KOH или
4K2S+4O3 = 3K2S+6O4 + K2S-2
3. Реакции внутримолекулярного окисления-восстановления
К этим реакциям относятся те реакции, в которых одно и то же вещество является одновременно и окислителем и восстановителем, причём степень окисления меняют атомы разных элементов, либо атомы одного и того же элемента с разными степенями окисления
2KCl+5O3-2 = 3O20 + 2KCl-1 или
N-3H4N +5O3 = N2+1O + 2H2O
По среде, в которой протекает ОВР, их можно подразделить на реакции
- в растворе
3Na2SO3 + K2Cr2O7 + 4H2SO4 = 3Na2SO4 + Cr2(So4)3 + K2SO4 + 2H2O;
- в газовой фазе
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(г)
- в твёрдой фазе
2Al(к) + Fe2O3(к) = 2Fe(к) + Al2O3(к)
Составление уравнений ОВР
Составление уравнений ОВР является непростой задачей, так как на протекание ОВР и природу получающихся продуктов оказывают влияние такие факторы как pH среды, концентрация реагирующих веществ, температура, давление, присутствие катализатора. Если исходные продукты задаются, то продукты реакции устанавливаются экспериментально, либо на основании окислительно-восстановительных характеристик реагирующих и предполагаемых получающихся веществ в данных конкретных условиях, что можно выявить руководствуясь периодическим законом Д.И.Менделеева, знанием электронного строения вещества, величин потенциалов ионизации, сродства к электрону, электроотрицательностей элементов, окислительно-восстановительных потенциалов и изобарных потенциалов образования веществ (энергий Гиббса). В нашем курсе химии при составлении химических уравнений ОВР, в основном, будем предполагать, что основные исходные и получающиеся вещества известны. К ним, при необходимости могут быть добавлены вода, щёлочи, кислоты.
По степеням окисления атомов веществ легко выявить окислитель и восстановитель среди исходных веществ, а также восстановленную форму окислителя и окисленную форму восстановителя среди продуктов реакции, легко определить число электронов, отданных восстановителем и присоединённых окислителем в ходе реакции, при этом коэффициенты в уравнении ОВР подбираются согласно правилу: общее число электронов, отданных восстановителем должно равняться общему числу электронов, принятых окислителем. Отметим, что уравнение ОВР с правильно подобранными коэффициентами является выражением закона сохранения масс веществ.
Существует несколько методов составления уравнений ОВР, из которых наиболее часто применяют либо метод электронного баланса (широко практикуется в школьном курсе), либо ионно-электронный, или метод полуреакций. В нашем курсе химии предпочтение отдаётся второму методу, поскольку, во-первых, в этом методе имеют дело с реально существующими частицами вещества типа MnO4- или SO4-2, а не мифические Mn+7 или S+6 в этих частицах, которые с позиций представлений о степени окисления могут преставить состояния атомов марганца и серы в MnO4- и SO4-2; во-вторых, в справочниках приведены ОВП для полуреакций, где представлены именно реально существующие частицы окислителей и восстановителей.
Рассмотрим на конкретном примере последовательность действий для получения материального баланса (для поиска коэффициентов) уравнения ОВР. Пусть к металлическому цинку добавляют подкисленный серной кислотой раствор перманганата калия:
Zn + KMnO4 + H2SO4 → ZnSO4 + MnSO4
набор исходных набор основных
продуктов реакции конечных продуктов реакции
1. Устанавливаем и расставляем степени окисления атомов, которые меняют степень окисления
Zn0 + KMn+7O4 + H2SO4 = Zn+2SO4 + Mn+2SO4
2. Выделяем реально существующие частицы, которые содержат атомы, меняющие степень окисления.
Zn0 + KMn+7O4 + H2SO4 = Zn+2SO4 + Mn+2SO4
3. Составляем полуреакции процесса окисления и восстановления, добиваясь в каждой из полуреакций электронного и материального балансов:
3.1. Zn0 – 2e = Zn+2 окисление, Zn0 - восстановитель;
3.2 (Mn +7O4)- + 8H+ +5e = Mn+2 + 4H2O восстановление, KMnO4 - окислитель
Здесь сначала прибавляем 5 электронов (5e). Добиваясь электронного баланса, затем добавляем 4 молекулы воды, чтобы уравнять атомы кислорода, а затем добавляем в левую часть полуреакции 8 ионов водорода (8H+). Получаем для полуреакции процесса восстановления электронный и материальный балансы. Отметим, что добавляемые частицы (H2O и 8H+) присутствуют в водном подкисленном растворе.
4. Добиваемся электронного баланса между полуреакциями процессов окисления и восстановления (число отданных электронов должно быть равным числу принятых электронов). Умножим первую полуреакцию на 5, вторую – на 2 и сложим левые и правые части между собой. Получим ионно – молекулярное уравнение ОВР с основными коэффициентами, которые подчеркнуты:
 Zn0 – 2e = Zn+2 5
Zn0 – 2e = Zn+2 5
MnO4- + 8H+ + 5e = Mn+2 + 4H2O 2

5Zn0 + 2MnO4- + 16H+ = 2Mn+2 + 5Zn+2 + 8H2O
5. Переносим основные коэффициенты в уравнение ОВР и, не меняя их, добиваемся материального баланса в уравнении, вводя, если необходимо, те дополнительные вещества, которые имеются в системе:
5Zn0 + 2KMnO4 + 8H2SO4 = 2MnSO4 + 5ZnSO4 + 8H2O + K2SO4
Рассмотренная методика применима к большому числу ОВР, однако имеются особые случаи:
1. Иногда восстановитель или окислитель дополнительно расходуется на связывание образующихся в результате реакции продуктов. Например
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
Здесь две молекулы HCl выступают в роли восстановителя, а две расходуются на связывание Mn+2.
