Способы выражения концентрации раствора. Концентрацией раствора называется весовое (в случае газа объемное) содержание растворенного вещества в весовом количестве или в определенном объеме раствора
Концентрацией раствора называется весовое (в случае газа объемное) содержание растворенного вещества в весовом количестве или в определенном объеме раствора. Растворы с большой концентрацией называются концентрированными, с малой - разбавленными. Концентрацию растворов выражают разными способами.
1. Массовая доля (w) показывает, какая масса растворенного вещества
содержится в 100 г раствора
w = m1/m2 ,
где m1 – масса растворенного вещества; m2 – масса раствора. Процентная концентрация раствора - w·100 %.
2. Молярная концентрация (См) показывает количество растворенного вещества ν , моль, которое содержится в 1 литре (1 дм3) раствора
См = ν /V , моль/л,
где V – объем раствора в дм3.
Молярность раствора обозначается буквой М. Например, если в растворе содержится 1 моль вещества, то такой раствор называется молярным – 1 М; 0,1 моль – децимолярным (0,1 М); 0,01 моль – сантимолярным (0,01 М); 0,001 моль – миллимолярным (0,001 М).
3. Эквивалентная (Сн) или нормальная (Н.) концентрация выражается числом эквивалентов растворенного вещества в 1 литре (1 дм3) раствора
Сн = m/ Mэ· V , моль/л,
где m - масса растворенного вещества , г; Mэ – молярная эквивалентная масса растворенного вещества (г/моль); V - объем раствора (л).
4. Мольная доля (c) растворенного вещества А – отношение числа его
молей νА к общему числу молей. Если в растворе содержатся вещества А, В, С, то
c = νА/ νА + νВ + νС .
5. Моляльная концентрация (Сm) - количество растворенного вещества, приходящееся на 1 кг растворителя. Единица измерения Сm - моль/кг.
6. Титр раствора показывает, сколько граммов растворенного вещества находится в 1 мл раствора. Зная нормальность раствора, титр вычисляют по формуле
Т = Н.· Мэ/ 1000 , г/мл.
Электролитическая диссоциация
Вещества, растворы (или расплавы) которых проводят электрический ток, называются э л е к т р о л и т а м и. Нередко электролитами называют и сами растворы этих веществ. Эти растворы (расплавы) электролитов являются проводниками второго рода, так как передача электричества осуществляется в них движением и о н о в - заряженных частиц. Частица, заряженная положительно называется катионом (Са+2), частица несущая отрицательный заряд - анионом (ОН־). Ионы могут быть простые (Са+2, Н+) и сложные (РО4 ־3, НСО3 ־2).
Основоположником теории электролитической диссоциации является шведский ученый С. Аррениус. Согласно теории электролитической диссоциацией называется распад молекул на ионы при их растворении в воде, причем это происходит без воздействия электрического тока. Однако эта теория не отвечала на вопросы: какие причины обусловливают появление в растворах ионов и почему положительные ионы, сталкиваясь с отрицательными, не образуют нейтральных частиц.
Свой вклад в развитие этой теории внесли русские ученые: Д.И. Менделеев, И. А. Каблуков – сторонники химической теории растворов, обращавшие внимание на влияние растворителя в процессе диссоциации. Каблуков утверждал, что растворенное вещество взаимодействует с растворителем (процесс с о л ь в а т а ц и и) образуя продукты переменного состава (с о л ь в а т ы).
Сольват представляет собой ион, окруженный молекулами растворителя (сольватная оболочка), которых может быть разное количество (именно за счет этого достигается переменный состав). Если растворителем является вода, то процесс взаимодействия молекул растворенного вещества и растворителя называется г и д р а т а ц и е й, а продукт взаимодействия - г и д р а т о м.
Таким образом, причиной электролитической диссоциации является сольватация (гидратация). И именно сольватация (гидратация) ионов препятствует обратному соединению в нейтральные молекулы.
Количественно процесс диссоциации характеризуется величиной степени электролитической диссоциации (α), которая представляет собой отношение количества распавшегося на ионы вещества к общему количеству растворенного вещества.Отсюда следует, что для сильных электролитов α = 1 или 100 % (в растворе присутствуют ионы растворенного вещества), для слабых электролитов 0 < α < 1 (в растворе присутствуют наряду с ионами растворенного вещества и его недиссоциированные молекулы), для неэлектролитов α = 0 (ионы в растворе отсутствуют). Помимо природы растворенного вещества и растворителя величина α зависит от концентрации раствора и температуры.
Если растворителем является вода, к сильным электролитам относятся:
1) все соли;
2) следующие кислоты: HCl, HBr, HI, H2SO4, HNO3, HClO4;
3) следующие основания: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Процесс электролитической диссоциации является обратимым, следовательно, его можно охарактеризовать величиной константы равновесия, которая, в случае слабого электролита, называется константой диссоциации (КД).
Чем больше эта величина, тем легче электролит распадается на ионы, тем больше его ионов в растворе. Например: HF ═ H+ + F־
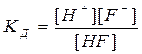 .
.
Эта величина постоянная при данной температуре и зависит от природы электролита, растворителя.
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато. Например, молекулы серной кислоты в первую очередь отщепляют один катион водорода:
H2SO4 ═ Н+ + HSO4־.
Отщепление второго иона по уравнению
HSO4־═ Н+ + SO4־2
идет уже значительно труднее, так как ему приходится преодолевать притяжение со стороны двухзарядного иона SO4־2, который, конечно, притягивает к себе ион водорода сильнее, чем однозарядный ион HSO4־ . Поэтому вторая ступень диссоциации происходит в гораздо меньшей степени, чем первая.
Основания, содержащие более одной гидроксильной группы в молекуле, тоже диссоциируют ступенчато. Например:
Ba(OH)2 ═ BaOH+ + OH- ;
BaOH+ = Ba2+ + OH-.
Средние (нормальные) соли всегда диссоциируют на ионы металлов и кислотных остатков:
CaCl2 = Ca2+ + 2Cl- ;
Na2SO4 = 2Na+ + SO42-.
Кислые соли, подобно многоосновным кислотам, диссоциируют ступенчато. Например:
NaHCO3 = Na+ + HCO3- ;
HCO3- = H+ + CO3 2-.
Однако степень диссоциации по второй ступени очень мала, так что раствор кислой соли содержит лишь незначительное число ионов водорода.
Основные соли диссоциируют на ионы основных и кислотных остатков. Например:
Fe(OH)Cl2 = FeOH2+ + 2Cl-.
Вторичной диссоциации ионов основных остатков на ионы металла и гидроксила почти не происходит.
