Характеристика минеральных вяжущих веществ
В данном пособии мы рассматриваем только некоторые вяжущие вещества: строительную известь, гипсовые вяжущие вещества и цемент (на примере портландцемента).
Строительная известь. Строительная известь – это простейшее местное вяжущее вещество, получаемое путем обжига известняков, мела, ракушечника и других природных материалов. Главной составной частью извести является оксид кальция СаО (негашеная известь). Процесс производства извести заключается в обжиге, который ведется в печах различных систем:
СаСО3 = СаО + СО2↑.
Температура разложения чистого карбоната кальция равна 880°С. Практически обжиг известняка ведут при температуре 1000–1200°С.
Гашение извести. Вода поглощается негашеной известью, всасываясь в поры и одновременно химически взаимодействуя с оксидом кальция с выделением большого количества тепла по уравнению
СаО + Н2О = Са(ОН)2, (∆Н°=–65,3 кДж/моль).
Твердение извести. Известковое тесто, обладающее пластичностью, затвердевает постепенно. Известь является медленнотвердеющим вяжущим веществом. Наряду с этим находящаяся на поверхности Са(ОН)2 поглощает из воздуха углекислый газ СО2. Происходит очень медленная карбонизация (образование СаСО3):
Са(ОН)2 + СО2 = СаСО3.
Из насыщенной жидкой фазы известкового теста, вследствие малой растворимости, выделяются Са(ОН)2 и СаСО3, сначала в коллоидном состоянии, потом в кристаллическом. Состав известкового камня: СаСО3 + Са(ОН)2.
Гипсовые вяжущие вещества.Гипсовые вяжущие вещества содержат в своем составе сульфат кальция. Сырьем для их получения служат двуводный гипс СаSО4∙2H2O и природный ангидрит СаSО4; могут быть также использованы отходы химической промышленности, состоящие в основном из СаSО4, например, фосфогипс.
При производстве гипсовых вяжущих веществ происходит дегидратация двуводного сульфата кальция СаSО4∙2H2O, который при сравнительно низкой температуре отщепляет кристаллизационную воду, превращаясь в полугидрат сульфата кальция СаSО4∙0,5H2O.
Степень дегидратации гипса зависит от температуры. Процессы дегидратации идут по следующим схемам:
СаSО4∙2H2O = СаSО4∙0,5H2O + 1,5H2O,
150–170°С гипсовое вяжущее вещество;
СаSО4∙2H2O = СаSО4 + 2Н2 О,
1000°С ангидритовое вяжущее вещество.
Твердение гипсовых вяжущих. Строительный гипс СаSО4∙0,5H2O представляет собой воздушное быстротвердеющее вяжущее вещество. При обычных температурах при взаимодействии гипсовых вяжущих с водой происходит образование двуводного сульфата кальция, который является более устойчивой формой, чем полуводный сульфат кальция, и обладает меньшей растворимостью.
Реакция протекает по схеме:
СаSО4∙0,5H2O + 1,5Н2О = СаSО4∙2H2O.
В жидкой фазе возникают условия для образования зародышей кристаллов двуводного гипса и выкристаллизовывания их из раствора.
Выделившиеся из раствора кристаллы гипса растут, переплетаются, срастаются, что и обуславливает схватывание и твердение исходной смеси.
В состав гипсового камня входит СаSО4∙2H2O.
Цемент. Основными материалами в современном строительстве являются цемент и его разновидность – портландцемент, из которого изготавливают бетон и железобетон.
В качестве сырья для производства портландцемента используют породы, состоящие из карбоната кальция – 75% (известняка) и силикатов алюминия (глина) – 25% по массе.
Для изготовления портландцемента используют и другие материалы аналогичного состава, например, мергели.
Обжиг сырья производится в горизонтальной (с небольшим наклоном) вращающейся цилиндрической печи длиной до 100…170 м и диаметром до 5 м. Процесс происходит непрерывно. Обжигаемый материал проходит через зоны с различной температурой (всего VI зон). Рассмотрим процессы, происходящие в этих зонах.
I зона (до 100°С). Сырьевая смесь высушивается, и из нее в виде пара удаляется химически несвязанная вода.
II зона (500…800°С). Частицы глины теряют химически связанную воду и каолинит (Н4Аl2Si2O9) превращается частично в смесь безводного силиката алюминия (Al2Si2O7) и аморфного диоксида кремния (SiO2), частично в смесь оксидов.
III зона (900…1200°С). Происходит разложение СаСО3 по реакции:
СаСО3 = СаО + СО2↑.
В III зоне начинаются также реакции взаимодействия оксида кальция с продуктами распада каолинита:
СаО + Al2O3 = Ca(AlO2)2,
2CaO + SiO2 = Ca2SiO4.
IV зона (100...1250°С). Завершается образование двухкальциевого силиката (Са2SiO4): однокальциевый алюминат [Ca(AlO2)2] постепенно переходит в трехкальциевый алюминат:
Ca(AlO2)2 + 2СаО = Са3(АlО3)2.
Часть оксида кальция еще остается свободной.
V зона (1250…1450°С). Происходит частичное плавление материала и завершаются реакции образования силикатов и алюминатов кальция. Например, происходит частичный переход двухкальциевого силиката в трехкальциевый:
Са3SiO4 + СаО = Ca3SiO5.
Материал спекается и образует зернистую массу, называемую цементным клинкером. Размеры зерен клинкера 7…20 мм.
VI зона. Клинкер охлаждается до 1000…1200°С.
При выходе из печи клинкер охлаждается, его размалывают, смешивают с гипсом (5% к общей массе) и используют как гидравлическое вяжущее вещество, называемое портландцементом.
Химический состав цементного клинкера. Для получения высокого качества цемента необходимо, чтобы его химический состав и состав сырьевой смеси были устойчивы.
Химический состав цементного клинкера обычно выражают условно-процентным содержанием оксидов: СаО (60…77 вес. %), SiO2 (19…34%), Al2O3 (4…7%), Fe2O3 (2…6%).
Химико-минералогический состав цемента. Цементный клинкер представляет собой смесь солей (минералов), основные из которых силикаты, алюминаты и алюмоферриты кальция.
Взаимодействие минералов цементного клинкера с водой.
Цементный клинкер получают при высокой температуре, поэтому все минералы его представляют собой безводные соединения, обладающие избытком свободной энергии и в связи с этим термодинамически неустойчивые.
В табл. 11.1 представлен примерный химико-минералогический состав клинкера портландцемента.
Таблица11.1
| Название минерала цементного клинкера | Химическая формула | Примерное содержание в клинкере, % |
| Трехкальциевый силикат (алит) | Ca3SiO5 | 40…60 |
| Двухкальциевый силикат (белит) | β - Ca2SiO4 (β-2CaO·SiO2) | 15…40 |
| Трехкальциевый алюминат | Ca3(AlO3) (3CaO·Al2O3) | 5…15 |
| Четырехкальциевый алюмоферрит (целит) | Ca4(AlO3) (FeO2)2 (4CaO·Al2O3·Fe2O3) | 10… 20 |
Размолотый портландцементный клинкер при смешивании с водой образует однородную пастообразную смесь, называемую цементным тестом. Это тесто представляет собой высококонцентрированную суспензию частиц цемента в воде. Все минералы цементного клинкера при комнатной температуре в небольшой степени растворимы в воде. Как и все неорганические соли, они подвергаются электролитической диссоциации, в результате которой в растворе присутствуют ионы Са2+ и ионы кислотных остатков, например, AlO33-, SiO44- и др.
Трехкальциевый силикат (алит) Са3SiO5 является химически активным веществом, взаимодействует с водой: ∆Н°гидр=–502,7 Дж/г, причем за трое суток он гидратируется примерно на 70-80%. Продукт гидратации (гидролиза) обладает способностью твердеть с образованием материала, имеющего высокую прочность.
| Са3SiO5 + (n+1)Н2О = Са2 SiO4·nН2О + Са(ОН)2. | |
| двухкальциевый гидросиликат |
Высокое значение рН, которое обусловлено присутствием Са(ОН)2, обеспечивает устойчивость гидросиликатов кальция. Кроме того, гидроксид кальция обеспечивает высокую щелочность поровой жидкости бетона (рН>12). Благодаря этому стальная арматура в бетоне находится в пассивном, состоянии и не подвергается коррозии.
Двухкальциевый силикат (белит) β-Са2SiO4 менее активен. ∆Н°гидр=–259,78 Дж/г. Скорость гидратации весьма незначительна. За трое суток гидратируется примерно 10% белита, а для завершения гидратации необходимо несколько месяцев, даже при условии очень тонкого размельчения белита.
Необходимо отметить, что из белита получается качественный и прочный цементный камень, но при длительном сроке твердения:
| β-Са2SiO4 + nН2О = Са2SiO4·nН2О. | |
| двухкальциевый гидросиликат |
В результате гидролиза алита и белита образуется гидросиликат кальция состава Са2SO4·nН2О, где n=1,17. Наличие такого коэффициента означает, что полученный продукт представляет собой смесь гидросиликатов различного состава. Это в основном кислые соли ортокремневой кислоты Н4SiO4.
Таким образом, гидросиликаты кальция являются смесью кислых солей ортокремневой кислоты, например, Ca(H3SiO4)2, CaH2SiO4, Са3(НSiO4)2 и т.д.
При нагревании степень гидролиза увеличивается. Например, белит при тепловлажностной обработке может гидролизоваться с выделением свободного Са(ОН)2 по схеме:
2 β-Ca2SiO4 + 2H2O ↔ Ca3(HSiO4)2 + Ca(OH)2.
Трехкальциевый алюминат Са(АlO3)2 является самым активным минералом цементного клинкера. Тепловыделение при полной гидратации достигает 850,57 Дж/г. Схватывание происходит за несколько минут, но прочность получаемого продукта низкая. Состав продуктов гидратации сильно зависит от условий гидратации. При 250°С наиболее устойчива форма Са3(АlO3)2·6Н2О, в которую постепенно переходят другие формы гидроалюминатов кальция. Поэтому гидратацию трехкальциевого алюмината можно выразить уравнением:
| Са3(АlO3)2 + 6Н2О ↔ Са3(АlO3)2·6Н2О. | |
| гидроалюминат кальция |
Эта реакция протекает очень быстро. В результате образования гидроалюмината кальция (ГАК) происходит схватывание, что делает невозможным операции перемешивания, укладки, перевозки цементного теста. Кроме того, раннее структурообразование за счет непрочного ГАК в цементном тесте сильно снижает прочность цементного камня.
Для того чтобы устранить этот недостаток, замедлить эту реакцию, цементный клинкер при измельчении смешивают с гипсом, который взаимодействует с находящимся в растворе гидроалюминатом кальция, образуя кристаллы малорастворимой двойной соли – гидросульфоалюмината кальция:
| Саэ(АlO3)2 + 3СаSО4·2Н2О + 25Н2О ↔ Саз(АlO3)2·3СаSО4·31Н2О. | |
| гидросульфоалюминат кальция |
Образование гидросульфоалюмината кальция в начальный период твердения является положительным фактором, так как предотвращает нежелательное раннее схватывание и способствует повышению конечной прочности цементного камня.
Четырехкальциевый алюмоферрит (целит) Са4(АlO3)2(FеО2)2
является двойной солью, в состав которой входит кальций, два
кислотных остатка АlO33- (алюминиевая кислота Н3АlO3) и FеО22-
(железистая кислота НFеО2). Целит является медленно гидратирующимся веществом. Скорость гидратации его несколько выше, чем у белита, ∆Н°гидр=–419 Дж/г.
Целит дает продукт достаточно высокой прочности. Процесс протекает по схеме:
| Са4(АlO3)2(FеО2)2 + (n+2)H2O = Са3(АlO3)2·6Н2О + Са(FеО2)2·nН2О. | ||
| гидроалюминат кальция | гидроферрит кальция |
Образующийся гидроферрит кальция может в дальнейшем взаимодействовать с Са(ОН)2, который получается в результате гидратации силикатных составляющих цемента.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Лабораторная работа
«Ионные равновесия в растворах электролитов»
Опыт 1.Влияние природы растворителя на степень диссоциации
1. Налейте в пробирку из капельницы 8…10 капель спиртового раствора хлорида меди (CuCl2) и прибавьте несколько капель воды до изменения окраски раствора.
Объясните это явление. Какую окраску вызывают ассоциированные ионы, а какую – гидратированные ионы меди?
2. Напишите уравнение диссоциации CuCl2 с учетом установившегося равновесия. Укажите, в какую сторону сместится ионное равновесие при разбавлении.
Сделайте вывод о том, как влияет природа растворителя на степень диссоциации электролита.
Опыт 2.Влияние одноименного иона на степень диссоциации электролита
1. Возьмите пробирку с водным раствором CuCl2 и прибавьте к нему из капельницы концентрированной соляной кислоты до изменения окраски раствора. Чем вызвано это изменение?
2. Учитывая результаты первого опыта, определите, как влияет добавление HCl на ионное равновесие в растворе хлорида меди.
Покажите на уравнении диссоциации, в какую сторону смещается равновесие между свободными и ассоциированными ионами в растворе при введении в него одноименного иона.
Сделайте вывод о том, как изменяется степень диссоциации электролита при введении в его раствор одноименного иона.
Опыт 3.Уменьшение степени диссоциации основания при добавлении одноименного катиона
1. Налейте 1/4 объема пробирки дистиллированной воды, прибавьте 1-2 капли индикатора – фенолфталеина и 1 каплю раствора гидроксида аммония NH4OH.
Что наблюдается? Какие ионы вызывают окрашивание раствора?
Напишите уравнение диссоциации NH4OH с учетом установившегося равновесия и выражение константы его диссоциации.
2. Прибавляйте кристаллики соли NH4Cl до обесцвечивания раствора.
Покажите на уравнении диссоциации NH4OH, в какую сторону смещается равновесие между ионами и молекулами в растворе NH4OH при введении одноименного иона NH4+.
Опыт 4.Влияние одноименного иона на растворимость соли
1. Налейте 1/4 объема пробирки насыщенного раствора поваренной соли NaCl (нас.р-р), прибавьте из капельницы концентрированной соляной кислоты. Что наблюдается?
2. Составьте уравнение диссоциации хлорида натрия в насыщенном растворе. Укажите, как смещается ионное равновесие в присутствии одноименных ионов в гетерогенной системе.
Опыт 5.Амфотерные свойства гидроксида алюминия Al(OH)3
1. Налейте 1/3 пробирки раствора соли алюминия – Al2(SO4)3 и прибавьте несколько капель раствора NH4OH.
Какое вещество выпадает в осадок? Приведите уравнения реакций в молекулярной и ионной формах.
2. Половину содержимого пробирки перелейте в другую пробирку. После этого в первую пробирку прилейте кислоты (HNO3), а во вторую – щелочи (NaOH) до растворения осадка.
Приведите уравнения реакций в молекулярной и ионной формах.
3. Напишите уравнение диссоциации гидроксида алюминия Al(OH)3 по щелочному и кислотному типу и составьте выражения соответствующих констант диссоциации.
Определите, как влияет на установившееся в растворе равновесие прибавление кислоты, щелочи. Как изменяется при этом степень диссоциации Al(OH)3 по кислотному и щелочному типам?
Опыт 7.Определение рН сильной и слабой кислот
1. С помощью универсальной индикаторной бумаги определите рН раствора соляной кислоты (Сэк = 0,1 моль экв/л) и раствора уксусной кислоты (Сэк = 0,1 моль экв/л).
2. Рассчитайте концентрацию ионов [Н+]. Результаты запишите в таблицу:
| Концентрация, моль экв/л | Сэк НCl = 0,1 | Сэк СH3COOH = 0,1 |
| pH | ||
| [H+] |
Сделайте вывод о величинах степеней диссоциации в растворах соляной и уксусной кислот.
Напишите уравнения электролитической диссоциации этих кислот.
Опыт 8.Гидролиз солей
Определите рН растворов следующих солей: NaCl, Na2CO3, Al2(SO4)3, CH3COONH4. Результаты занесите в таблицу:
| Соль | рН | Соль | рН |
| NaCl | Al2(SO4)3 | ||
| Na2CO3 | CH3COONH4 |
Напишите в молекулярной и ионно-молекулярных формах уравнения гидролиза указанных солей.
Сделайте вывод о том, какие соли подвергаются гидролизу.
ЛАБОРАТОРНАЯ РАБОТА
«Коррозия и защита металлов»
Опыт 1. Влияние образования гальванических элементов на коррозию металлов
1. В пробирку с разбавленной серной кислотой поместите кусочек цинка. Наблюдайте скорость выделения водорода.
2. Прикоснитесь к цинку, находящемуся в пробирке с H2SO4, медной палочкой. Объясните, почему интенсивность выделения водорода при контакте с медью больше, чем в отсутствии меди.
Укажите место выделения водорода. Приведите схему образующегося гальванического элемента.
На основании проделанного опыта сделайте вывод о том, какое влияние на коррозию металла оказывает его контакт с другими металлами.
3. В две пробирки налейте одинаковое количество разбавленной серной кислоты и в одну из них добавьте 1-2 капли раствора CuSO4. В обе пробирки поместите по таблетке цинка.
Укажите, в каком случае наблюдается наиболее интенсивное выделение водорода?
При помещении Zn в сложный электролит (H2SO4+CuSO4) происходит образование микрогальванических элементов Zn/ZnSO4½H2SO4½2H+/H2 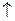 (Cu).
(Cu).
| Эксперимент | |||
| Металлы | Zn | Zn/Cu | Zn |
| Электролиты | H2SO4 | H2SO4 | H2SO4+CuSО4 |
| Наблюдаемые явления | |||
| Ионно-электронные схемы процесса |
Укажите, какая химическая реакция приводит к образованию меди во второй пробирке?
Приведите схемы образующихся микрогальванических элементов.
Результаты опыта оформите в виде таблицы и ответов на вопросы.
Опыт 2. Коррозия луженого и оцинкованного железа
1. Качественная реакция на ион [Fe2+]. В пробирку налейте несколько капель раствора сульфата железа (II) и добавить 1-2 капли раствора К3[Fe(CN)6].
Появление синего окрашивания обусловлено реакцией:
| 3Fe2+ + 2Fe [(CN)6]3- = Fe3[ Fe(CN)6]2, | |
| турнбуллева синь |
с образованием образуется турнбуллевой сини.
2. Налейте в химический стакан 100 мл воды, добавьте 3-4 капли разбавленной серной кислоты и такое же количество раствора К3[Fe(CN)6]. Раствор перемешайте и разлейте поровну в две фарфоровые чашки. В одну из них поместите пластинку оцинкованного железа (Fe/Zn), в другую – железную пластинку с наплавленным кусочком олова (Fe/Sn).
Заметьте время от погружения пластинок до появления синего окрашивания.
Результаты опыта оформите в виде таблицы и ответов на вопросы.
| Электролит | H2SO4 | |
| Fe/ металл покрытия | Fe/Zn | Fe/Sn |
| Наблюдаемые явления | ||
| Ионно-электронные схемы процессов |
Объясните, почему при контакте железа с цинком скорость коррозии ниже, чем при его контакте с оловом.
Укажите направление перехода электронов в парах Fe/Zn и Fe/Sn. На каком металле в обоих случаях происходит выделение водорода?
Приведите схемы образующихся гальванических элементов. Укажите, какое покрытие для железа является анодным, а какое –катодным?
На основании проделанных опытов сделайте вывод о том, что происходит с металлом (Fe) после нарушения анодного и катодного покрытий.
Опыт 3. Коррозия железа в результате различного доступа кислорода
На обезжиренную сухую железную пластинку поместите каплю специального реактива, содержащего 3%-ный раствор NaCl, к которому добавлен K3 [Fe(CN)6] и фенолфталеин.
Раствор NaCl – среда, в которой протекает коррозия железа; K3 [Fe(CN)6] – реактив на ион [Fe2+]; фенолфталеин – индикатор, цвет которого меняется на малиновый в щелочной среде.
Изучите изменение окраски в центре капли и по ее окружности. Коррозия железа вызвана неоднородностью коррозионной среды, обусловленной в данном случае неравномерной аэрацией капли (неодинаковым доступом воздуха к ее различным слоям).
В образующемся коррозионном микрогальваническом элементе центральная часть смоченной поверхности металла является анодным участком, а периферическая (в виде кольца малинового цвета) – катодным.
Анодные участки подвергаются разрушению (появление синего окрашивания обусловлено образованием турнбуллевой сини).
На катодных участках протекает процесс восстановления растворенного кислорода.
Приведите уравнения реакций электродных процессов и схему образующегося коррозионного микрогальванического элемента.
Опыт 4. Влияние хлорид - ионов на коррозию алюминия
1. В две пробирки поместите 1-2 кусочка алюминия и добавьте в одну из пробирок 2-3 мл раствора CuSO4, в другую – CuCl2 той же концентрации.
Убедитесь в том, что отношение Al к растворам взятых солей различно.
2. В пробирку, содержащую CuSO4, добавьте небольшое количество кристаллической соли NaCl. Что наблюдается?
Результаты опыта оформите в виде таблицы и ответов на вопросы.
| Металл | Al | ||
| Электролит | CuSO4 | CuCl2 | CuSO4 + NaClкр. |
| Наблюдаемые явления | |||
| Ионно-электронные схемы процесса |
На основании значений стандартных электродных потенциалов Al и Cu определите возможность протекания реакции:
Al + CuSO4 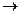 .
.
Объясните, почему результаты опыта не согласуются с теоретическими выводами?
Учитывая, что анион Cl- является активатором и способствует разрушению оксидных пленок, объясните, в результате образования каких микрогальванических элементов происходит коррозия Al. Приведите ионно-электронные уравнения окислительно-восстановительных процессов и схемы образующихся при коррозии Al микрогальванических элементов (коррозия протекает с выделением водорода на катодных участках, объясните почему?).
КОНТРОЛЬНЫЕ ВОПРОСЫ
