Хлорная вода. Получение, свойства, применение.
II. Химия неорганических соединений, биологическая роль, применение в ветеринарии.
- Общая характеристика подгруппы галогенов.


Способы получения галогенов. Применение.
В лаборатории:
- Получение хлора. Хлор получают действием соляной кислоты на окислители: MnO2, KMnO4, PbO2, K2Cr2O7 и другие:
16HCl + 2KMnO4 = 5Cl2 + 2MnCl2 + 2KCl + 8H2O.
- Бром и йод получают действием окислителя на бромиды или йодиды в кислой среде:
MnO2 + 2KBr + 2H2SO4 = Br2 + MnSO4 + K2SO4 + 2H2O;
2NaNO2 + 2NaI + 2H2SO4 = I2 + 2NO + 2NaHSO4 + 2H2O.
В промышленности:
- Важнейший способ получения фтора – электролиз расплавов фторидов. В качестве основного источника используется гидрофторид калия KHF2, фтор выделяется на аноде.
- Хлор в промышленности получают электролизом раствора хлорида натрия. Газообразный хлор выделяется на аноде:
2NaCl + 2H2O = 2NaOH + H2 + Cl2.
- Для получения брома используют реакцию его замещения в бромидах:
2KBr + Cl2 = 2KCl + Br2.
- Основные источники получения йода – морские водоросли и нефтяные буровые воды:
2NaI + MnO2 + 3H2SO4 = I2 + 2NaHSO4 + MnSO4 + 2H2O.
Применение: галогены используются в химической промышленности, для очистки воды и отходов, в производстве пластмасс, фармацевтических препаратов, целлюлозы и бумаги, тканей, смазочных материалов. Бром, хлор, фтор и йод служат химическими промежуточными звеньями, отбеливающими и дезинфицирующими средствами. Бром и хлор применяются в текстильной промышленности для отбеливания и предотвращения усадки шерсти. Бром также используется в процессах экстракции золота и при бурении нефтяных и газовых скважин. Он применяется как антипирен в производстве пластмасс и как промежуточное звено в производстве гидравлических жидкостей, хладагентов, влагопоглотителей и средств для завивки волос. Бром входит в состав боевых отравляющих газов и огнегасящих жидкостей.
Водородные соединения галогенов. Свойства, применение.







HF + H2SO4 ≠ реакция не идёт
HCl + H2SO4 ≠ реакция не идёт
2HBr + H2SO4 = Br2 + SO2 + 2H2O
8HI + H2SO4 = 4I2 + H2S + 4H2O
Йодоводород является сильным восстановителем и используется как восстановитель во многих органических синтезах. При стоянии, раствор HI вследствие постепенного окисления HI кислородом воздуха и выделения йода, принимает бурую окраску:
4HI + O2 → 2H2O + 2I2
Растворы галогенов — сильные кислоты, в которых ион H+ выступает в качестве окислителя. Галогеноводородные кислоты реагируют с металлами, потенциал которых < 0, но так как ионы I−(в меньшей степени Br−) хорошие комплекообразователи, HI может реагировать даже с серебром (+0,8).
2Ag + 4HI = 2H[AgI2] + H2
Хлорная вода. Получение, свойства, применение.
Получение: 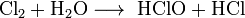
Химические свойства: 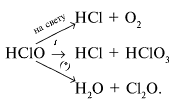
Применение: Используется для обеззараживания воды в бассейнах способом хлорирования, очень слабый раствор хлора в питьевой воде обеспечивает ее обеззараживания без нанесения большого ущерба здоровью.
