Тесты для самостоятельной работы студентов
Вариант 1
1. В реакцию с NaOH будет вступать:
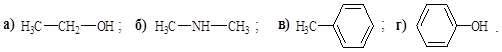
2. Наиболее сильным основанием будет:
а) аминобензол; б) 1-амино-2-метилбензол;
в) 1-амино-2-нитробензол; г) 1-амино-2-гидроксибензол.
3. Кислотность пропантиола больше пропанола, т.к.:
а) электроотрицательность у кислорода больше чем у серы;
б) поляризуемость серы больше;
в) больше молекулярная масса;
г) лучшая растворимость
4. Согласно теории Бренстеда, кислотными свойствами обладают молекулы или ионы, способные:
а) отдавать протон; б) отдавать электрон;
в) принимать протон; г) принимать электрон.
5. Более основной характер диметиламина по сравнению с анилином доказывает реакция с:
а) HNO2; б) CH3Cl; в) HCl; г) H2О
Вариант 2
1. Согласно теории Бренстеда, основными свойствами обладают молекулы или ионы, способные:
а) отдавать протон; б) отдавать электрон;
в) принимать протон; г) принимать электрон.
2. Более сильной кислотой является:
а) пропанол-1; б) пропандиол-1,2;
в) пропиламин; г) пропантиол-1
3. Более сильные кислотные свойства этантиола по сравнению с этанолом можно доказать реакцией с:
а) СН3–СН2–Cl; б) HgCl2; в) NaOH; г) Na.
4. Наиболее сильными основными свойствами обладает соединение:
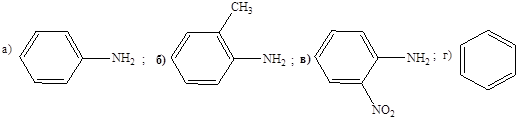
5. Отрицательный мезомерный эффект усиливает кислотные свойства в соединении:
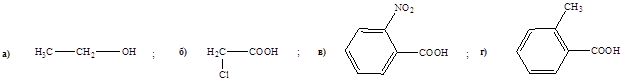
Вариант 3
1. Наиболее слабым основанием является соединение:
а) С2Н5–NH2; б) (С2Н5)2–NH;
в) С6Н5–NH2; г) NO2–C6H4–NH2.
2. С NaOH с образованием солей будет реагировать соединение:
а) пропанол-1; б) 2-метилпропанол-2;
в) оксибензол; г) этиламин.
3. Этантиол является более сильной кислотой чем этиламин, т.к.:
а) атом серы легче поляризуется; б) азот более электроотрицателен;
в) радикал проявляет +J; г) SH-группа проявляет –J.
4. Этанол и нарколан (2,2,2-трибромэтанол) применяются в качестве нарколитических средств. Большая кислотность нарколана объясняется:
а) отсутствием сопряжения; б) ЭА характером брома;
в) +J эффектом радкала; г) – J эффектом ОН-группы.
5. Наиболее сильные кислотные свойства фенола по сравнению со спиртами можно доказать реакцией:
а) С6Н5–ОН + Na →; б) С6Н5–ОН + НNО3 →;
в) С6Н5–ОН + FeCl3 →; г) С6Н5–ОН + NaOH →;
Вариант 4
1. Наиболее слабой кислотой является:
а) уксусная кислота; б) пропандиовая кислота;
в) пропионовая кислота; г) щавелевая кислота;
2. Большая основность 1-амино-2-метилбензола по сравнению с анилином объясняется:
а) – J эффектом NH2-группы; б) +М эффектом NH2-группы;
в) ЭД характером группы СН3; г) ЭА характером NH2-группы;
3. Большие кислотные свойства глицерина по сравнению с пропанолом проявляются в реакции с:
а) HCl; б) Cu(OH)2; в) CuO; г) CH3–OH;
4. С Na2CO3 как более сильная кислота будет взаимодействовать соединение:
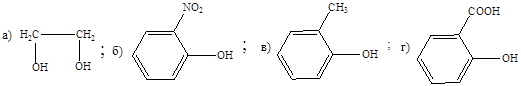
5. Соединение, способное образовывать соли с HgO:
а) фенол; б) 1,2-диоксибензол;
в) пропантиол-2; г) пропандиол-1,2;
Вариант 5
1. Основность соединений зависит от:
а) молекулярной массы; б) характера заместителя;
в) температуры г) давления.
2. В реакции с СН3СООН более сильные основные свойства доказывает соединение:
а) С2Н5–ОН + СН3СООН →; б) С6Н5–NН2 + СН3СООН →;
в) СН3–CH2–NН2 + СН3СООН →; г) СН3–COОН + Na →
3. Более сильные кислотные свойства этантиола по сравнению с этиламином можно объяснить:
а) + J эффектом заместителя; б) – J эффектом SH-группы;
в) – J эффектом NН2-группы; г) большей поляризуемостью атома серы.
4. Наиболее сильным основанием является соединение:
а) СН3–NH2; б) СН3–СН2–NH–СН3;
в) С6Н5–NH2; г) С6Н5–NH–C6H5.
5. Стабильность аниона зависит:
а) числа атомов водорода в радикале;
б) величина радикала; в) заряд ядра;
г) делокализации электронной плотности.
Ответы к обучающим тестам
| № теста | Номер вопроса | ||||
| г | б | б | а | г | |
| в | г | б | б | в | |
| г | в | а | б | в | |
| г | в | б | г | в | |
| б | в | г | б | г |
Рекомендуемая литература
Основная
1.Н. А. Тюкавкина, Органическая химия, 2002 г. С. 100-101, 108-109.
Дополнительная
1. Грандберг И. И. Органическая химия М., Дрофа, 2001. С. 95 - 98
