Опыт 3. Химическая идентификация (обнаружение) и измерение веществ.
Цели работы: Идентификация анализируемых растворов на присутствие в них опасных ионов (качественный анализ); устранение опасных ионов осаждением с помощью раствора щелочи; количественная оценка изменения концентрации ионов (количественный анализ).
Химическая идентификация – это ответ на вопрос, какое вещество присутствует в интересующей нас системе (качественный анализ) и сколько этого вещества содержится в системе (количественный анализ). Такое исследование особенно актуально в настоящее время для оценки экологической обстановки. Качественный анализ позволяет определить качество, а количественный дает информацию о том, превышает или нет концентрация вещества его предельно допустимую концентрацию (ПДК) в системе. В основе качественного анализа лежит знание химического поведения веществ, например в виде ионов, по отношению к действию определенной группы соединений, называемых реагентами, а также знание свойств образующихся продуктов реакции (растворимость в воде, кислотах, щелочах, в растворах некоторых веществ (реагентов), способность к образованию веществ сложного состава (комплексообразование).
Это знание особенностей химического поведения веществ позволяет выделить реакции обнарыжения, т.е. такие химические реакции анализируемого вещества с реагентом, при которых образуют продукты, имеющие заметные признаки:
Образование характерных осадков и их цвета
Растворение осадков
Появление (изменение) окраски при растворении осадков
Выделение газов
Перечисленные признаки являются аналитическим сигналом, под которым понимается различная информация, которую можно зафиксировать визуально (цвет раствора, осадка и др.) либо зафиксировать инструментально и которая свидетельствует о присутствии и количестве того или иного вещества в системе.
Часто в качественном и количественном анализах рассматривается образование осадков в реакции с реагентом, причем в качественном анализе – для идентификации.
Чтобы идентифицировать раствор на присутствие в нем опасного иона, в данной лабораторной работе используется химическая реакция, в результате которой образуется трудно растворимое соединение – осадок.
Цвет и поведение этого осадка с определенным реагентом, дает опорную информацию, указывающую на конкретный ион.
Экспериментальная часть.
Опишем опыт 1
Дана пробирка с исходным раствором. Сравним цвет исходного раствора с данными в таблице 1

Согласно полученной информации исходный раствор может содержать следующие ионы:
Zn(II), Cd(II), Pb(II), Al(III) или Ba(II)
Для получения осадка (гидроксида), к исходному раствору добавляем 3 капли водного раствора щёлочи (NaOH) и наблюдением.
Сравним цвет выпавшего осадка с информацией в таблице №2.
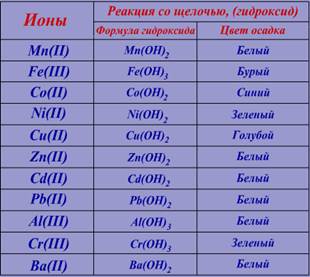
Следовательно в растворе возможно присутствие следующих ионов: Zn(II), Cd(II), Pb(II), Al(III) или Ba(II)
Полученный осадок разделим на 2 части
К первой части добавим избыток щёлочи (NaOH) и наблюдаем
Сравним результат реакции с информацией в таблице №3
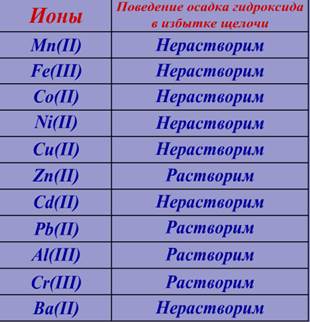
Следовательно в растворе возможно присутствие следующих ионов: Cd(II), Ba(II)
Ко второй части осадка добавим водный раствор аммиака (NH4OH) и наблюдаем.
Сравним результат реакции с информацией в таблице №4
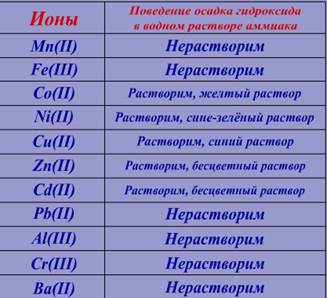
Следовательно в растворе возможно присутствие следующих ионов: Cd(II)
Для подтверждения нашего предложения, о присутствии в анализируемом растворе ионов Cd(II) выполним специфическую реакцию.
Для этого к исходному раствору добавим йодистый калий (Na2S) и наблюдаем.
Следовательно в растворе возможно присутствие следующих ионов: Cd(II)
Проделаем тоже самое и для второй пробирки, результаты занесем в таблицу
| ионы | Цвет исходного раствора | Реакция с щелочью, гидроксид | Поведение осадка гидроксида | Специфические реакции | Результат реакции | ||
| Формула гидроксида | Цвет остатка | В избытке щелочи | В водном растворе аммиака | ||||
| Zn(II) Cd(II) Pb(II) Al(III) Ba(II) | бесцветный | Zn(OH)2 Cd(OH)2 Ba(OH)2 Pb(OH)2 Al(OH)2 | белый | нерастворим Cd(II), Ba(II) | растворим Cd(II) | Добавим Na2S | Следовательно в растворе возможно присутствие следующих ионов: Cd(II) Результат реакции – янтарный |
| Cr(III) Ni(II) | зеленый | Cr(OH)3 Ni(OH)2 | Зеленый | нерастворим Ni(II) | Растворим, сине-зеленый раствор Ni(II) | Добавим сульфат натрия Na2S | Следовательно в растворе возможно присутствие следующих ионов: Ni(II) Результат реакции – Черный |
Вывод:
Первый раствор содержит Cd(II), а второй Ni(II). Что подтверждается проделанной выше работой и ее проверкой.
