Диаграмма. состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии
I. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ
АНАЛИЗ ДИАГРАММ СОСТОЯНИЙ ДВУХКОМПОНЕНТНЫ X СИСТЕМ
Цель занятия - изучить и освоить основные методы анализа диаграмм состояния двухкомпонентных систем.
ВВЕДЕНИЕ
Приступая к практическому занятии, студенты должны иметь четкие представления о том, что такое металлический сплав, что понимается под компонентами сплава, его фазами и структурными составляющими. Необходимо также тщательно проработать по конспекту лекций и учебникам вопросы о типах и строении фаз в металлических сплавах и условиях их образования.
Следует запомнить, что диаграмма состояния - это графическое изображение состояния сплавов изучаемой системы в зависимости от их химического состава и температуры.
Диаграммы состояния показывают устойчивые, равновесные, состояния сплавов, т.е такие, которые при данных условиях обладают минимальной свободной энергией. Поэтому их называют также и диаграммами фазового равновесия. Необходимо усвоить, что, зная диаграмму состояния, можно представить полную картину формирования структуры любого сплава, определить температуры литья и обработки давлением, установить возможность проведения и режимы термической обработки металлоизделий.
Закономерности всех изменений в многофазной системе подчиняются правилу фаз Гиббса. Оно дает возможность предсказать и проверить процессы, происходящие в сплавах при нагреве V. охлаждении; показывает, происходит ли кристаллизация припостоянной температуре или в определенном температурном интервале, указывает, какое количество фаз может одновременно находиться в равновесии. Правило фаз устанавливает следующую зависимость между числом степеней свободы С ( вариантностью) системы, числом компонентов К и числом фаз Ф , находящихся в равновесии:
С=К-Ф+2
Числом степеней свободы С называется число независимых внешних и внутренних факторов С температура, давление, концентрация), которые можно изменять, не изменяя числа фаз, находящихся в равновесии.
При построении диаграмм состояния металлических сплавов давление принимают постоянным, тогда:
С=К-Ф+1
Этим уравнением необходимо уметь пользоваться при проведении настоящей работы.
Уясните, что диаграммы состояния строят экспериментально, используя наиболее часто термический метод, с помощью которого получают кривые охлаждения отдельных сплавов системы в координатах время-температура. По остановкам и перегибам на этих кривых определяют температуры превращений.
Температуры, соответствующие фазовым превращениям, называются критическими точками.
Точки, отвечающие началу кристаллизации, называются точками ликвидуса, а концу кристаллизации - точками солидуса.
По полученным кривым охлаждения ( критическим точкам )строят диаграмму состояния в координатах: по оси абсцисс - концентрация компонентов, по оси ординат - температура.
ОБЩИЕ УКАЗАНИЯ
При подготовке к практическому занятию студенты должны тщательно проработать настоящие методические указания и соответствующий материал в рекомендуемых учебных пособиях.
Необходимо зарисовать изучаемые диаграммы, разобраться в их особенностях и составить четкое представление о процессах структурообразования в сплавах различной концентрации. При анализе каждой из диаграмм необходимо освоить и научиться практически использовать правила отрезков и правило фаз применительно к разным температурам и уметь изображать характерные структуры сплавов.
Не следует полностью переписывать текст методических указаний, но основные положения целесообразно законспектировать. Степень подготовленности студента к опросу, проводимому преподавателем,- проверяется с помощью вопросов для самоконтроля.
ДИАГРАММА. СОСТОЯНИЯ СПЛАВОВ С НЕОГРАНИЧЕННОЙ РАСТВОРИМОСТЬЮ КОМПОНЕНТОВ В ТВЕРДОМ СОСТОЯНИИ
Вспомним, что полная взаимная растворимость в твердом состоянии возможна лишь для металлов с однотипными (изоморфными) и близкими по периодам кристаллическими решетками, образующих при сплавлении непрерывный ряд твердых растворов замещения. Соответствующая этому случаю диаграмма представлена на рис. I.
Имеем: компоненты А ( например, Сu ) и В ( например, Ni); фазы - жидкий раствор Ж и твердый раствор α.
Поле диаграммы разделено на три области фазового состояния, разделяемые линиями tACtB и tADtB. Линия tACtb представляет собой геометрическое место то ликвидус и называется линией ликвидуса.
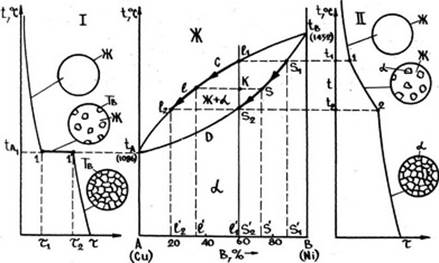 Выше этой линии все сплавы находятся в жидком состоянии. Линия tADtB - геометрическое место точек солидус - называется линией солидуса, ниже которой все сплавы находятся в твердом состоянии. Область между этими линиями соответствует равновесию жидкости и кристаллов твердой фазы.
Выше этой линии все сплавы находятся в жидком состоянии. Линия tADtB - геометрическое место точек солидус - называется линией солидуса, ниже которой все сплавы находятся в твердом состоянии. Область между этими линиями соответствует равновесию жидкости и кристаллов твердой фазы.
Вначале получают кривые охлаждения для чистых компонентов, а затем для сплавов различного состава.
Кривая I получена при охлаждении компонента А ( Сu ). Выше температуры tА (для меди - 1086°С ) металл находится в жидком состоянии. Кристаллизация начинается при этой температуре через промежуток времени τ1 и заканчивается в момент τ2 . Согласно правилу фаз, имеем: компонент I ( металл А ), фазы 2 ( жидкий металл и кристаллы А ), следовательно, С = К - Ф + 1 = 1 - 2 + 1= 0, т.е. кристаллизация должна происходить при постоянной температуре. Ниже температуры tA происходит только охлаждение образовавшихся кристаллов компонента А. Аналогичные процессы происходят и при охлаждении компонента B.
Сплав II, содержащий, например, 60 % компонента B ( Ni ) и 40 % компонента A ( Сu ) выше температуры t1 ( точка l1 на линии ликвидуса ) находится в состоянии однородного жидкого раствора. При этой температуре жидкий раствор становится насыщенным по отношению к α-фазе и начинается кристаллизация, сопровождающаяся уменьшением скорости охлаждения. В интервале температур t1-t2 находятся две фазы: насыщенные жидкий и твердый растворы. Поскольку в данном случае количество компонентов К = 2, то С = 2 - 2+1 = 1, из чего следует, что кристаллизация сплава должна происходить в интервале температур. В этом состоит существенное отличие процесса кристаллизации двухкомпонентных сплавов от процесса кристаллизации чистых компонентов, происходящего при постоянной температуре.
__________________________________________________
При температуре t2 ( точка S2 на линии солидуса ) кристаллизация сплава заканчивается, и ниже ее никаких превращений не происходит.
Аналогичные процессы происходят и при охлаждении всех других сплавов, образованных компонентами А и В.
Следует усвоить, что в процессе кристаллизации изменяются химический состав ( концентрация ) фаз и количество каждой «вы. Пользуясь диаграммой состояния, можно в той области диаграммы, где существует две фазы, определить их состав и относительные количества при любой температуре. Для этого необходима использовать правила отрезков.
Запомните, что первое правило отрез -: о в применяет для определения состава фаз. Так, например, для того, чтобы в сплаве П ( рис. I ) определить составы жидкой и твердой фазы при температуре Ь черв» точку К характеризующую состояние сплава при этой температуре, надо пролети горизонтальную линию - коноду до пересечения с линями, ограничивающими данную двухфазную область. Проекция точки пересечения коноды с линией ликвидус l на ось концентраций – точка I - показывает состав жидкой фазы, а проекция точки пересечения S к он оды с линией оолндус на эту ось - точка S` состав твердой фазы.
Из рис. I видно, что состав первых кристаллов твердого раствора α, образовавшихся при температуре t1 , отвечает точке S`1 , а последних г при температуре t2 - точке S`2 , т.е. вменяется в соответствии с линией солидус на участке l1- l2. Состав жидкой фазы изменяется при этом от l1- в начале кристаллизации до l2. в конце, т.е. в соответствии с линией ликвидус на участке l1- l2.
Это может быть записано в виде:
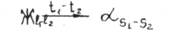 |
Для определения количеств ( массы или объема ) каждой на фаз в двухфазной области при какой-либо температуре следует применять второе правило отрезков. Так, например, для сплава Ц ( рис. I) о этой целью также надо использовать коноду ГЛ , проведенную до грант двухфазной об-ласги через точку К . характеризующую ооотояние сплава при температуре Ъ . Обратите внимание на то, что количество твердой фазы яС определяется при этом отношением длины отрезка &К , прншкающего к области жидкой фазе, по всей длине коноды 15 , т.е.
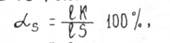 |
а количество жидкой фазы - отношением отрезка К5 , примыкающего к области твердой фазы, также к длине этой коноды:
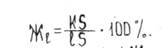 |
(Индекоы S и l при буквах α и β указывают состав твердой и жидкой фаз соответственно при заданной температуре t).
