Робота № 9/3. Вивчення кінетики омилення складних ефірів у присутності іонів водню
Мета роботи. Визначити середнє значення константи швидкості реакції омилення складного ефіру водою
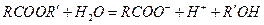 .
.
Методика роботи. У розведених ефірних розчинах внаслідок великого надлишку води омилення відбувається практично повністю, але дуже повільно. Оскільки іони Н+ каталізують процес, то реакцію проводять у кислому середовищі. Одним з продуктів реакції омилення ефірів є кислота, тому реакція омилення є автокаталітичним процесом, що ускладнює перебіг реакції. Однак якщо початкова концентрація іонів водню є високою, то збільшення концентрації кислоти буде відносно невеликим. Тому реакцію проводять у присутності значної кількості сильної кислоти (наприклад HCl). За великого надлишку води швидкість омилення буде залежати тільки від концентрації ефіру (реакція 1-го порядку). Тому швидкість буде визначатися рівняннями:
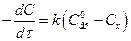 ; (1)
; (1)
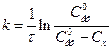 , (2)
, (2)
де 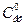 - початкова концентрація ефіру; Сх - концентрація ефіру, що прореагував (вона дорівнює концентрації кислоти, що утворилася);
- початкова концентрація ефіру; Сх - концентрація ефіру, що прореагував (вона дорівнює концентрації кислоти, що утворилася);  - концентрація ефіру в момент часу τ.
- концентрація ефіру в момент часу τ.
Оскільки кількість кислоти під час протікання реакції безперервно збільшується, про швидкість реакції можна судити за збільшенням кількості розчину лугу, що йде на титрування проб реагуючої суміші.
Порядок роботи. Встановлюють термостат на задану температуру. У ретельно вимиту і пропарену колбу ємкістю 250 мл заливають 100 мл розчину HCl (концентрація HCl і температура термостата вказується викладачем). Колбу встановлюють у термостат і через 15 хв додають до кислоти 5 мл етилацетату. Суміш збовтують і в той самий час відбирають піпеткою пробу 5 мл. Момент вливання етилацетату вважається початком реакції. Колбу закривають, а взяту пробу швидко вливають в іншу колбу, в яку для гальмування реакції залито 50 мл холодної дистильованої води (t = 0-3°С). Після цього пробу титрують у присутності фенолфталеїну 0,1 н розчином їдкого барію. Титрування вважається закінченим, якщо рожевий колір зберігається протягом 2-3 с. Потім, не виймаючи колбу з термостата, через 15, 30, 60, 90, 120, 180 хв після початку реакції відбирають проби і проводять титрування. За час відбору проби приймають момент її вливання в холодну воду.
Після відбору останньої проби колбу з розчином закривають, підписують і здають лаборанту.
Через 48 год після початку реакції суміш нагрівають протягом 30 хв на водяній бані з оберненим холодильником за температури 70-80°С, після чого проводять титрування проби.
Позначимо через V0, Vτ та V∞ кількість мілілітрів лугу, що йде на титрування 5 мл суміші відповідно на початку реакції, в момент часу τта після закінчення реакції.
Результати вимірювань заносять до таблиці:
| Температура ____ °С; концентрація HCl = _____ н | |||
| Час відбору проби | Проміжок часу від початку реакції | Кількість розчину Ba(OH)2 на титрування проби | Константа швидкості |
Початкова концентрація ефіру 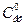 є пропорційною різниці
є пропорційною різниці 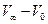 , а концентрація ефіру в даний момент часу
, а концентрація ефіру в даний момент часу  - різниці
- різниці  . Відповідно до рівняння (1)
. Відповідно до рівняння (1)
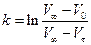 . (3)
. (3)
Підставляючи в це рівняння величини V0, Vτ та V∞, розраховують константу швидкості реакції k і заносять її значення до таблиці. Визначають середнє значення константи швидкості.
Література: [21].
ЕЛЕКТРОХІМІЯ. ЕЛЕКТРОЛІТИ
Розчини електролітів. Ізотонічний коефіцієнт Вант-Гоффа. Теорія електролітичної дисоціації Арреніуса. Причини дисоціації, сольватація. Сильні та слабкі електроліти. Константа електролітичної дисоціації, закон розведення Оствальда. Електролітична дисоціація води, рН розчинів. Гідроліз. Теорія кислот та основ Бренстеда, протолітична рівновага.
Активність у розчинах електролітів, теорія Дебая - Хюккеля. Іонна атмосфера.
Електропровідність розчинів електролітів. Числа переносу та методи їх визначення. Закон незалежності руху іонів Кольрауша. Питома та еквівалентна електропровідність розчинів слабких та сильних електролітів та її залежність від концентрації. Теорія електропровідності сильних електролітів Дебая - Хюккеля - Онзагера. Електрофоретичний і релаксаційний ефекти. Протонний механізм переносу електрики в розчинах.
Література: [1,2, 4, 5, 7, 9-12].
