Экспериментальное определение теплот (энтальпий)химических процессов
Теплоты (энтальпии) химических процессов
Энергетические явления, сопровождающие химические реакции, имеют очень большое практическое значение. Так, реакции сгорания углеводородов, угля, водорода, магния, реакции в гальванических элементах, взрывные реакции — производятся специально для получения энергии. Все энергетические потребности организмов, начиная от простейших и до человека, также обеспечиваются химическими реакциями. Зеленые растения запасают энергию солнечного излучения в молекулах глюкозы, а все остальные организмы ее тратят, окисляя глюкозу и временно храня порции энергии в специальных веществах типа АТФ. Для этого клетки снабжены особыми органами — митохондриями. Для более длительного хранения запасов энергии организмы превращают глюкозу в жиры. Эксперименты показывают, что превращения веществ in vivo и in vitro сопровождаются одинаковыми суммарными энергетическими эффектами. Поэтому положения химической термодинамики справедливы как для реакций в лабораторных и производственных условиях, так и в живых организмах. Человек за сутки затрачивает в среднем при массе 70 кг 11,3 МДж энергии (в медицине не вышла из употребления и более старая единица измерения — килокалория; 11,3 МДж = 2700 ккал). Фактические затраты зависят от возраста, пола, состояния здоровья, климатических условий, характера труда. С учетом всего этого рассчитываются и планируются нормы потребления пищевых продуктов, необходимые их запасы и т д.
Для практических и научных целей возможно экспериментальное и расчетное определение энергетических эффектов — теплоты и максимальной работы реакций.
Ознакомление на первом курсе с методами измерения и расчета теплоты (ΔH) и максимальной работы (ΔG) химических реакций необходимо для последующего изучения биохимии, физиологии, терапии, гигиены.
Экспериментальное определение теплот (энтальпий)химических процессов
Все разновидности химических и физико-химических процессов — химические реакции, растворение и кристаллизация, фазовые переходы, ионизация — сопровождаются различными энергетическими эффектами: выделением теплоты, излучением, возникновением электрического тока, совершением механической работы. Различные виды энергии в конечном счете переходят в тепловую энергию. Поэтому для общей энергетической характеристики химических процессов целесообразно измерять или рассчитывать теплоты процессов, равные изменению энтальпии ΔH в изобарно-изотермических условиях.
Для определения теплоты процесса служит калориметр. Этот прибор состоит из сосуда для проведения химической реакции, погруженного в емкость с водой, которой передается большая часть выделяющейся при реакции теплоты. По изменению температуры воды, ее массе и удельной теплоемкости вычисляют общее количество переданной теплоты Q. Затем количество теплоты пересчитывают на 1 г реагирующего вещества (удельная теплота) или на молярное количество вещества, соответствующее уравнению реакции.
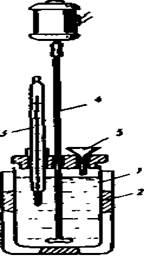 |
Рис. 1. Схема калориметра
Для веществ, способных сгорать в кислороде, хорошо отработано определение теплоты сгорания ΔHc. Для этого применяют калориметр, в котором для проведения реакции служит толстостенный, герметически закрывающийся металлический сосуд — калориметрическая бомба. В сосуд помещают пробу вещества и кислород под давлением в избытке. Реакция в смеси инициируется искрой, создаваемой электрическим разрядом. Этим методом, в частности, определяют калорийность или теплотворную способность различных пищевых продуктов.
Несколько другие типы калориметров (рис. 4.1.) применяют для измерения теплот реакций, протекающих в водных растворах. В этом случае теплота реакции передается в основном воде (или, наоборот, забирается у воды) как растворителя. Потери теплоты в калориметре по возможности уменьшают, помещая сосуд с раствором 1 во внешнюю оболочку 2. Целесообразно применение в качестве калориметра сосуда Дьюара. Калориметр снабжается точным термометром 3, мешалкой 4для быстрого достижения однородности раствора и воронкой 5 для внесения в сосуд реагирующих веществ. Теплоту, выделяющуюся в калориметре, рассчитывают по общей теплоемкости Ст всех частей калориметра и изменению температуры: Q = Cm ΔT. Массу реагирующих веществ и воды подбирают таким образом, чтобы изменение температуры было невелико, и процесс был близок к изотермическому.
