Задания для текущих и промежуточных контролей
Раздел I
1. Процесс образования диоксида углерода при сжигании графита в кислороде может протекать двумя путями:
I. 2C(гр)+О2(г) = 2СО(г); 2CO(г) + О2 = 2СО2(г), DrН° = -566 кДж.
II. C(гр) + О2(г) = СО2(г), DrН° = -393 кДж.
Найдите DfH°(CO).
Ответ: -110 кДж/моль.
2. Рассчитайте энтальпию образования и энтальпию сгорания монооксида углерода (СО), исходя из приведенных ниже реакций:
I. 2С(гр) + О2(г) = 2СО(г), DrН° = -220 кДж.
II. 2СО(г) + О2(г) = 2СО2(г), DrН° = -566 кДж.
Ответ: -110 кДж/моль; -283 кДж/моль.
3. Найдите стандартную энтальпию образования сульфита натрия из термохимического уравнения
4Na2SO3(кр)= 3Na2SO3(кр)+ Na2S(кр) – 181,1 кДж,
если 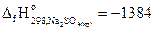 кДж/моль и
кДж/моль и  кДж/моль.
кДж/моль.
Ответ: -1090 кДж/моль.
4. Найдите стандартную энтальпию сгорания метана, исходя из реакции СН4(г) + 2О2(г) = СО2(г) + 2Н2О(г), DrН°= -802 кДж.
Ответ: -802 кДж/моль.
5. Предскажите, положительным или отрицательным будет
изменение энтропии системы в реакциях:
а) Н2О(ж) ® Н2О(г) (при температуре 25 °С);
б) СаСО3(т) ® СаО(т) + СО2(г);
в) N2(г) + 3Н2(г) = 2NH3(г);
г) N2(г) + О2(г) = 2NO(г);
д) Ag+(р-р) + Cl-(р-р) = AgCl(т).
Дайте объяснения, не производя расчетов.
Ответ: а) +; б) +; в) -; г) ~0; д) -.
6. Предскажите знак DS системы в каждом из следующих
процессов:
а) испарение 1 моль CCl4(ж);
б) Br2(г) → Br2(ж);
в) осаждение AgCl(т) при смешении NaCl(водн.) и AgNO3(водн.).
Дайте объяснения.
Ответ: а) +; б) -; в)-.
7. Пользуясь табличными значениями абсолютных значений энтропий веществ при стандартных условиях (S°), сравните значения абсолютных энтропий веществ при температуре 298 К в каждой из перечисленных ниже пар:
а) О2(г) и О3(г);
б) С(алмаз) и С(графит);
в) NaCl(т) и MgCl2(т).
Объясните причину различия S° в каждом случае.
8. Вычислите DrS° для реакций
а) N2(г) + 3Н2(г) = 2NH3(г); б) 2SO2(г) + О2(г) = 2SO3(г),
используя табличные значения абсолютных энтропий веществ при стандартных условиях.
Ответ: а) -197,74 Дж/К; б) -188,06 Дж/К.
9. Пользуясь табличными значениями абсолютных эн-
тропий (S°), вычислите DrS° для следующих процессов:
а) СО(г) + 2Н2(г) = СН3ОН(г);
б) 2НСl(г) + Br2(ж) = 2HBr(г) + Cl2(г);
в) 2NO2(г) = N2O4(г).
Согласуется ли в каждом случае знак величины DrS° с тем, который следует ожидать на основе качественных представлений? Ответы объясните.
Ответ: а) -218,83 Дж/К; б) 94,15 Дж/К; в) -175,77 Дж/К.
10. Стандартная энтальпия образования СО(г) составляет -110,5 кДж/моль. При сгорании 2 моль СО(г) выделилось 566 кДж теплоты. Вычислите 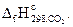
Ответ: -393,5 кДж/моль.
11. Определите количество теплоты, выделяющееся при гашении 100 кг извести водой: CaO(к) + H2O(ж) = Ca(OH)2(к), если стандартные теплоты образования CaO(к), H2O(ж), Ca(OH)2(к) равны соответственно -635,14; -285,84; -986,2 кДж/моль.
Ответ: -1165357,2 кДж.
12. Определите энтальпию разложения пероксида водорода (Н2О2) на воду и кислород, используя нижеприведенные данные:
SnCl2(р) + 2НCl(p) + H2O2(p) = SnCl4(p) + 2H2O(ж), DrН°=-393,3 кДж;
SnCl2(р) + 2HCl(p) + 1/2O2(г) = SnCl4(p) + H2O(ж), DrН°=-296,6 кДж.
Ответ: - 96,7 кДж.
13. Вычислите количество теплоты, которое выделяется при производстве 106 кг аммиака в сутки, если
N2(г) + 3Н2(г) = 2NH3(г), DrН° = -92 кДж.
Ответ: -2,7.109 кДж.
14. Определите 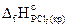 , исходя из следующих данных:
, исходя из следующих данных:
Р4(кр) + 6Cl2(г) = 4РСl3(ж), DrН° = -1272,0 кДж;
PCl3(ж) + Cl2(г) = PCl5(кр), DrН° = -137,2 кДж.
Ответ: -455,2 кДж/моль.
15. Вычислите изменение энтальпии реакции при стандартных условиях: Н2(г) + 1/3О3(г) = Н2О(г), исходя из следующих данных:
2О3(г)=3О2(г), DrН°=-288,9 кДж,
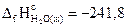 кДж/моль.
кДж/моль.
Ответ: -289,95 кДж.
16. Рассчитайте стандартную энтальпию реакции образования PbO, используя следующие данные:
1) 2Pb(кр)+О2(г)=2PbO2(кр) – 553,2 кДж;
2) 2PbO2(кр)= 2PbO(кр) )+О2(г) + 117,48 кДж.
Ответ: -217,86 кДж/моль.
17. Рассчитайте стандартную энтальпию реакции образования CuCl, используя следующие данные:
1) CuCl2(кр)+Cu(кр)=2 CuCl(кр) – 63,5 кДж;
2) Cu(кр)+ Cl2(г)= CuCl2(кр) – 205,9 кДж.
Ответ: 134,7 кДж/моль.
18. Вычислите ΔfH° метилового спирта в жидком состоянии, зная следующие данные:
Н2(г) + 1/2О2(г) = Н2О(ж), DrН° = -285,8 кДж;
С(гр) + О2(г) = СО2(г), DrН° = -393,7 кДж;
СН3ОН(ж) + 3/2О2(г) = СО2(г) + 2Н2О(ж), DrН° = -715,0 кДж.
Ответ: -250,3 кДж/моль.
19. Стандартные энтальпии сгорания бензола и ацетилена равны соответственно -3270 и -1302 кДж/моль. Определите DrH° превращения ацетилена в бензол: 3С2Н2(г) = С6Н6(г).
Ответ: -636 кДж.
20. Определите стандартную энтальпию образования оксида железа (III), если при окислении 20 г железа выделилось 146,8 кДж теплоты.
Ответ: -822 кДж/моль.
21. Вычислите количество теплоты, которое выделяется при получении 22,4 л аммиака (н.у.), если
N2(г) + 3Н2(г) = 2NH3(г), DrН° = -92 кДж.
Ответ: -46 кДж.
22. Определите ΔfH° этилена, используя следующие дан
ные:
С2Н4(г) + 3О2(г) = 2СО2(г) + 2Н2О(г)-1323 кДж;
С(гр)+ О2(г) = СО2(г)-393,7 кДж;
Н2(г)+1/2О2(г)=Н2О(г)-241,8 кДж.
Ответ: 52 кДж/моль.
23.Рассчитайте энтальпию реакции F(г)+Li(г)=F-(г)+ Li+(г),
если F(г) + е = F-(г) -322 кДж/моль;
Li(г) = Li+(г) + е +520 кДж/моль.
Ответ: 198 кДж.
24. Рассчитайте стандартную энтальпию реакции образования Hg2Br2, используя следующие данные:
1) HgBr2(кр)+ Hg(ж)= Hg2Br2 (кр) – 37,32 кДж;
2) HgBr2 (кр)= Hg (ж)+ Br2(ж) +169,45 кДж.
Ответ: -206,77 кДж/моль.
25. Рассчитайте стандартную энтальпию реакции образования гидрокарбоната натрия, используя следующие данные:
2NaНСO3(кр)= Na2СO3(кр)+ СО2(г) +Н2О(г) + 130,3 кДж,
если 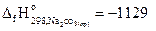 кДж/моль;
кДж/моль;
С(гр)+О2(г)=СО2(г)– 393,7 кДж; Н2(г)+1/2О2(г)=Н2О(г)-241,8 кДж.
Ответ: -947,4 кДж/моль.
26. Рассчитайте стандартную энтальпию реакции образования СaСO3(кр) , используя следующие данные:
Ca(OH)2(к)+ СО2(г)= СaСO3(кр)+173,9 кДж;
С(гр)+О2(г)=СО2(г) – 393,7 кДж;
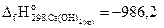 кДж/моль.
кДж/моль.
Ответ: -1206 кДж/моль.
27. Определите стандартную энтальпию образования оксида железа (III), если при реакции
2Fe + Al2O3 = Fe2O3 + 2Al
на каждые 80 г Fe2O3 поглощается 426,5 кДж теплоты, 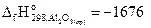 кДж/моль.
кДж/моль.
Ответ: -823 кДж/моль.
28. Какое количество теплоты необходимо затратить для получения 11,2 кг железа, если в соответствии с термохимическим уравнением FeO(т) + Н2(г) = Fe(т) + Н2О(г)+ 23 кДж.
Ответ: 4600 кДж.
29. Найдите теплоту сгорания алмаза, если стандартная теплота сгорания графита составляет -393,51 кДж/моль, а тепло-
та фазового перехода С(графит) ® С(алмаз) составляет
1,88 кДж/моль.
Ответ: -395,39 кДж/моль.
30. Какое количество теплоты выделяется при превращении 1 кг красного фосфора в черный фосфор, если известно,
что стандартные энтальпии образования красного и чёрного фосфора составляют -18,41 и -43,20 кДж/моль соответственно.
Ответ: -800 кДж.
Раздел II
Вычислите стандартное изменения энергии Гиббса химической реакции при температуре 25 °С по значениям стандартных энтальпий образования и абсолютных энтропий химических соединений и установите возможность самопроизвольного протекания реакции:
1. 4NH3г + 5O2г = 4NOг + 6H2Oг.
Ответ: -955,24 кДж; реакция возможна.
2. SO2г + 2H2Sг = 3Sк + 2H2Oж.
Ответ: -107,25 кДж; реакция возможна.
3. 2H2Sг + 3O2г = 2H2Oг + 2SO2г.
Ответ: -990,48 кДж; реакция возможна.
4. 2NOг + O3г + H2Oж = 2HNO3ж.
Ответ: - 260,94 кДж; реакция возможна.
5. 3Fe2O3к + COг = 2Fe3O4к + CO2г.
Ответ: - 64,51 кДж; реакция возможна.
6. 2СН3ОНж + 3О2г = 4Н2Ог + 2СО2г.
Ответ: - 1370,46 кДж; реакция возможна.
7. СН4г + 3СО2г = 4СОг + 2Н2Ог.
Ответ: 228,13 кДж; реакция невозможна.
8. Fe2O3к + 3COг = 2Feк + 3CO2г.
Ответ: -31,3 кДж; реакция возможна.
9. С2Н4г + 3О2г = 2СО2г + 2Н2Ог.
Ответ: -1313,9 кДж; реакция возможна.
10. 4NH3г + 3O2г = 6H2Oг + 2N2г.
Ответ: -1305,69 кДж; реакция возможна.
11. 4NO2г + O2г + 2H2Oж = 4HNO3ж.
Ответ: -55,08 кДж; реакция возможна.
12. 2HNO3ж + NOг = 3NO2г + H2Oж.
Ответ: -7,71 кДж; реакция возможна.
13. 2С2Н2г + 5О2г = 4СО2г + 2Н2Ог.
Ответ: -2452,81 кДж; реакция возможна.
14. Fe3O4к + 4H2г = 3Feк + 4H2Oг.
Ответ: 99,7 кДж; реакция невозможна.
15. 2Fe2O3к + 3Cк = 4Feк + 3СО2г.
Ответ: 297,7 кДж; реакция невозможна.
16. Fe3O4к + 4COг = 3Feк + 4CO2г.
Ответ: -14,88 кДж; реакция возможна.
17. 2H2Sг + O2г = 2H2Oж + 2Sк.
Ответ: -407,4 кДж; реакция возможна.
18. Fe2O3к + 3H2г = 2Feк + 3H2Oг.
Ответ: 54,47 кДж; реакция невозможна.
Вычислите стандартное изменение энергии Гиббса химической реакции при температуре 25 °С по значениям стандартных энтальпий образования и абсолютных энтропий химических соединений и определите, при какой температуре наступит равновесие в системе.
19. 4HClг + O2г ↔ 2Cl2г + 2H2Oж.
Ответ: -93,1 кДж; ~552 К.
20. Cl2г + 2HIг ↔ I2к + 2HClг.
Ответ: -194,0 кДж; ~1632 К.
21. SO2г + 2COг ↔ 2CO2г + Sк.
Ответ: -214,24 кДж; ~1462 К.
22. СН4г + 2Н2Ог ↔ СО2г + 4Н2г.
Ответ: 113,8 кДж; ~959 К.
23. СОг + 3Н2г ↔ СН4г + Н2Ог.
Ответ: -142,36 кДж; ~ 963 К.
Вычислите изменение энергии Гиббса химической реакции при температуре 350 °С по значениям стандартных энтальпий образования и абсолютных энтропий химических соединений. Температурной зависимостью DfH° и S° пренебречь. Установите возможность самопроизвольного протекания реакций:
24. 2РН3г + 4О2г = Р2О5к + 3Н2Ог.
Ответ: 1910,47 кДж; реакция возможна.
25. Cl2г + SO2г + 2H2Oж = H2SO4ж + 2HClг.
Ответ: -80,0 кДж; реакция возможна.
26. Р2О5к + 5Ск = 2Рк + 5СОг.
Ответ: 860,0 кДж; реакция невозможна.
27. 2COг + SO2г = Sк + 2CO2г.
Ответ: -154,4 кДж; реакция возможна.
28. СО2г + 4Н2г = СН4г + 2Н2Ог.
Ответ: -57,9 кДж; реакция возможна.
29. NOг + O3г = O2г + NO2г.
Ответ: -196,83 кДж; реакция возможна.
30. СН4г + 2О2г = СО2г + 2Н2Ог.
Ответ: -798,8 кДж; реакция возможна.
