Кинетические уравнения реакций различных порядков
1. Реакции первого порядка.
К этим реакциям относятся реакции изомеризации, термического разложения веществ, реакции радиоактивного распада и многие бимолекулярные реакции при условии, что концентрация одного из реагирующих веществ поддерживается постоянной.
Для реакции типа А → В скорость выражается уравнением:
V = - 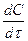 = К * СА (2.15)
= К * СА (2.15)
Или разделив переменные
- 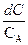 = К *
= К * 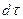 и проинтегрировав данное уравнение, получим:
и проинтегрировав данное уравнение, получим:
- ln CA = K * τ + const
Значение const можно определить из начальных условий. При τ = 0 концентрация вещества А в данный момент (СА) будет равна концентрации вещества А в начальный момент времени (СО,А). Следовательно, const = - ln CО,A В этом случае
- ln CA = К * τ - ln CО,А
Или
- ln CA + ln CО,А = К * τ
Из полученного выражения
К = 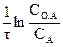 (2.16)
(2.16)
Это уравнение называется уравнением реакции первого порядка. Оно дает возможность вычислить концентрацию реагирующего вещества в любой момент времени по известной величине константы скорости или, наоборот, найти константу скорости реакции при заданной температуре путем определения концентрации в любой момент времени.
Если через Сх обозначить уменьшение концентрации исходного вещества к моменту времени τ, то уравнению можно придать вид:
К = 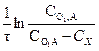 (2.17)
(2.17)
Для характеристики скорости реакции первого порядка наряду с константой скорости часто пользуются величиной, называемой периодом полураспада (τ1/2), то есть временем, необходимым для того, чтобы прореагировало половина взятого вещества. Принимая 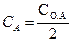 , из уравнения (2.16) находим:
, из уравнения (2.16) находим:
К = 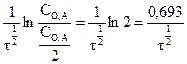 или
или 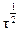 = 0,693/К (2.18)
= 0,693/К (2.18)
Из уравнения видно, что время полураспада для реакции первого порядка не зависит от количества вещества.
Следует также отметить, что константа скорости в уравнениях первого порядка имеет размерность обратного времени [K] = С-1, мин-1
2. Реакции второго порядка.
К ним принадлежит большинство бимолекулярных реакций и некоторые тримолекулярные. Реакции второго порядка можно представить схемой А + В → продукты реакции.
Скорость такой реакции определяется уравнением:
V = - 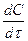 = К * СА * СВ
= К * СА * СВ
Где СА и СВ – концентрации реагирующих веществ в момент времени τ.
Рассмотрим простейший случай, когда концентрации двух реагирующих веществ одинаковы, тогда
- 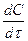 = К * С2 (2.20)
= К * С2 (2.20)
Разделить переменные 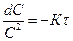 и проинтегрировав уравнение
и проинтегрировав уравнение
(С-2 * dc = 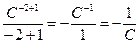 ) получим
) получим
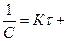 const (2.21)
const (2.21)
При τ = 0, С = Со, const = 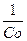 , тогда
, тогда 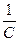 -
- 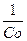 = Кτ или
= Кτ или
К = 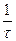 (
( 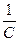 -
- 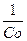 ) =
) = 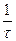 (
( 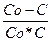 ) (2.22)
) (2.22)
Заменив С на Со - Сх, получим:
К = 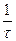 (
( 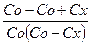 ) =
) = 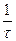 (
( 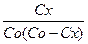 ) (2.23)
) (2.23)
При условии СА ≠ СВ уравнение скорости реакции в дифференциальной форме имеет вид:
- 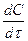 = К * СА * СВ = К (СО,А - СХ)(СО,В - СХ)
= К * СА * СВ = К (СО,А - СХ)(СО,В - СХ)
Разделив переменные
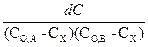 = - К * dτ и проинтегрировав, получим:
= - К * dτ и проинтегрировав, получим:
К = 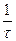
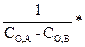 ln
ln 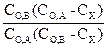 (2.24)
(2.24)
