Глава 1 Химическая термодинамика
Термодинамика в своей основе наука о температуре, теплоте и о превращении теплоты и работы друг в друга.
В соответствии с этим и названа от греческих слов «терме» и «динамис». Первое слово означает «теплота», вторым словом раньше выражали различные понятия: силу и работу.
Впервые термин «термодинамика» появился в статье В. Томсона в 1854 году. Томсон писал, «термо-динамика» в переводе означает «теплота-работа». Поэтому между основным содержанием термодинамики, как было изложено выше, и ее названием первоначально не было никакого противоречия. Оно возникло со временем, когда за «динамис» сохранилось понятие силы.
В дальнейшем цели термодинамики значительно расширились, и во второй половине XIX столетия основные ее положения уже широко используются в различных областях науки, в том числе и химии.
Обычно принято различать общую (физическую), техническую и химическую термодинамики.
В химической термодинамике изучается применение законов термодинамики к химическим и физико-химическим явлениям.
В ней рассматриваются главным образом:
1. тепловые балансы процессов, включая тепловые эффекты физических и химических процессов;
2. фазовые равновесия для индивидуальных веществ и смесей;
3. химическое равновесие.
Тепловые балансы составляют на основе первого начала термодинамики.
Анализ фазового и химического равновесий осуществляется на основе второго и третьего законов (начал) в термодинамике. Изучение законов, которые описывают химические и физические равновесия, имеет особое значение в химической термодинамике, их знание позволяет решить не прибегая к опыту, многие важнейшие задачи, встречающиеся в производственной, проектной и научно-исследовательской работе.
Главными задачами являются следующие:
1. Определение условий, при которых данный процесс становится возможным (без совершенствования работы из вне);
2. Нахождение пределов устойчивости изучаемого вещества или группы веществ в тех или иных условиях;
3. Выяснение, каким путем можно уменьшить количество получаемых при реакции нежелательных веществ;
4. Выбор оптимального режима процесса (t, p, c и т.д.)
Следующие примеры могут служить иллюстрацией значения термодинамики в химии.
Пример 1: Восстановление оксида железа в доменном процессе можно представить уравнением
Fe3O4 + 4CO = 3Fe + 4CО2
Отходящие газы содержат много оксида углерода (II). Решив, что причиной неполноты восстановления является недостаточное время соприкосновения оксида углерода (II) с рудой, стали строить более высокие печи. Были затрачены огромные средства, однако результаты оказались отрицательными – содержание СО практически не уменьшилось.
Позднее термодинамическим расчетом было установлено, что эта реакция в условиях доменной печи может протекать лишь до определенного предела, и значительное содержание оксида углерода неизбежно.
Пример 2: При разработке способа получения аммиака из водорода и азота уже с самого начала знали, что реакция обратима:
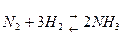
Выход аммиака можно увеличить, изменяя температуру, давление и концентрации веществ.
Термодинамический анализ условий равновесия показал, как зависит выход аммиака от давления и температуры.
Оказалось, что наиболее благоприятны давления порядка 1000 атм (101300 кПа) и температура 4750-5250С (~ 750 – 800 К)
На основании этих данных стали вести проектирование и строительство заводов по производству аммиака.
Пример 3: В 1927 году в Германии был запатентован метод получения уксусной кислоты из метана и диоксида углерода (СН4 + СО2 → СН3С 
 )
)
Предпринятые термодинамические, а затем и экспериментальные исследования показали, что синтез уксусной кислоты при указанных в патенте условиях практически невозможен.
На основе термодинамики можно показать, что синтез СН3СООН, причем с малым выходом, можно было бы осуществить при давлении несколько миллионов гектопаскалей и температуре порядка 1200 К.
Итак, реакция СН4 + СО2 = СН3СООН, хотя и очень заманчива, едва ли когда-нибудь будет использована для получения уксусной кислоты.
Пример 4: В конце XIX века были предприняты попытки получения алмаза из графита, но безуспешно. После того, как удалось определить свойства обеих модификаций углерода, выяснилось, что получение искусственного алмаза осуществлялось в условиях, в которых более устойчивым является графит.
Основные понятия и определения в термодинамике.
Термодинамическая система – это реально или мысленно отделенная от всего окружающего (внешней среды) группа тел или тело, которые могут энергетически взаимодействовать между собой или с другими телами и обмениваться с ними веществом.
Системой может быть газ в цилиндре, раствор реагентов, кристалл вещества. Как видно из определения система должна содержать достаточно большое число частиц (атомов, молекул, электронов), что бы к ней были применены такие понятия термодинамики, как теплота, температура, давление.
Часть системы с присущим ей химическим составом и макроскопическими свойствами называется фазой. Фазы отделены друг от друга физическими поверхностями, при переходе через которые свойства редко меняются. Например: вода – лед.
Если система состоит из одной фазы, то она называется гомогенной. Много фазная система является гетерогенной. Вещества, входящие в состав фаз, называются компонентами.
Система может по-разному взаимодействовать с внешней средой.
Термодинамическая система, которая обменивается энергией, но не допускает обмена массы с окружающей средой, называется закрытой.
Система, которая может обмениваться энергией и массой с окружающей средой, называется открытой.
Система, лишенная возможности обмениваться с окружающей средой как массой, так и энергией, называется изолированной. В изолированной системе с течением времени прекращаются всякие макроскопические изменения и значение любой физической величины в каждой точке системы остается постоянным.
Такое состояние изолированной системы называется равновесным.
Между частями термодинамической системы, находящейся в равновесном состоянии, отсутствует макроскопический перенос энергии. Равновесное состояние не может изменяться само собой, без внешних воздействий на систему. Состояние системы, которое остается неизменным во времени только благодаря некоторым изменениям в окружающей среде, называется стационарным.
Термодинамические параметры – физические и химические свойства (объем, давление, температура, химический состав) определяющие состояние системы. Среди свойств системы различают экстенсивные, зависящие от количества вещества, например объем и не зависящие от количества вещества – интенсивные. Экстенсивные величины, отнесенные к единице количества вещества, называются удельными. Удельные экстенсивные величины являются интенсивными величинами. Например: температура, концентрация и т.д.
Параметры состояния, поддающиеся непосредственному измерению, принято считать основными.
Между свойствами существует функциональная связь. Уравнение связывающее основные свойства системы, называют уравнением состояния; в общем виде его записывают так:
f = (p,v,Т) = 0(1.1)
Наиболее простым уравнением состояния является уравнение состояния идеального газа.
Pv = RТ или для v молей
Pv = vRТ (уравнение Менделеева-Клапейрона) (1.2)
Где, R = 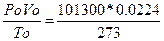
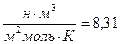 Дж/мольК – универсальная газовая постоянная.
Дж/мольК – универсальная газовая постоянная.
Газовая постоянная равна работе, производимой газом при изобарическом нагревании на 10. Некоторые свойства системы определяются как функции основных параметров и называются функциями состояния. Их изменения в каком-нибудь процессе зависят только от начального и конечного состояния и не зависят от пути перехода. Для них конечное изменение Δx=x2-x1, где x1 – значение данного свойства в начале процесса и x2 в конце.
К таким параметрам (функциям состояния) относятся внутренняя энергия – U, энтальпия – Н, энтропия – S, энергия Гельмгольца – F, энергия Гиббса – G.
