Лабораторная работа 7.2. Измерение электродного потенциала
Окислительно-восстановительного электрода
Цель работы: приготовление, измерение ЭДС и вычисление электродного потенциала окислительно-восстановительного электрода (по заданию преподавателя).
Реактивы: раствор калия иодистого концентрации 0,1 моль/л, йод кристаллический, раствор Fe(NH4)(SO4)2 концентрации 0,001 моль/л; раствор FeSO4(NH4)2SO4×6Н2О (соль Мора) концентрации 0,1 моль/л; раствор К3[Fe(CN)6] – красная кровяная соль концентрации 0,001 моль/л; раствор К4[Fe(CN)6] – желтая кровяная соль концентрации 0,1 моль/л; H2SO4 концентрированная; раствор H2SO4 концентрации 0,1 моль/л, хингидрон, раствор Вейбеля (с рН = 2,04).
Оборудование: платиновая проволока – 2 шт., химический стакан вместимостью 50 мл – 4 шт., солевой мостик, потенциометр ППТВ-1.
Методика работы
Окислительно-восстановительный электрод состоит из инертного металла (обычно платины), погруженного в раствор, содержащий окисленную и восстановленную формы вещества. В этом случае металл электрода не принимает участия в электродной реакции с ионами в растворе, а лишь выполняет роль проводника электронов, переходящих от одних атомов к другим в процессе определенной окислительно-восстановительной реакции.
Раствор, содержащий одновременно окисленную и восстановленную формы вещества, образует окислительно-восстано-вительную систему (редокс-систему). Платиновая проволока, опущенная в раствор солей FеCl2 и FeCl3, – пример окислительно-восстановительного электрода, потенциал которого зависит от соотношения окисленной и восстановленной форм в растворе.
Приготовить окислительно-восстановительный электрод по заданию преподавателя. Составить гальваническую цепь из исследуемого окислительно-восстановительного электрода и хингидронного электрода сравнения, например:
(–)Pt½ С6Н4О2, С6Н4(ОН)2, Н+(аСТ)½КС1½Ox,Red|Рt (+).
Полученную гальваническую цепь подсоединяют к потенциометру ППТВ-1 (методику работы на потенциометре см. в лаб. работе 7.1). ЭДС такого элемента измеряют методом компенсации. Если ЭДС цепи окажется слишком малой (менее 0,1 В, точка компенсации находится в крайнем положении на реохорде), необходимо включить последовательно элемент Вестона.
Измерив суммарное значение ЭДС такой цепи, вычисляют потенциал окислительно-восстановительного электрода:
Е =jOx,Red –jхг(СТ);jOx,Red = jхг(СТ) + E. (7.10)
Результаты оформить в виде табл. 7.2.
Таблица 7.2
Результаты эксперимента
| Окислительно-восстановительный электрод | ЭДС цепи Е, В | Потенциал окислительно-восстановительного электрода | |
| рассчитанный | табличный | ||
Лабораторная работа 7.3. Потенциометрическое титрование
Цель работы: освоение методики потенциометрического титрования.
Реактивы: раствор НС1 концентрации ~0,1 моль/л, раствор NaOH концентрации 1 моль/л.
Оборудование: стакан химический вместимостью 50 мл, бюретка на 25 мл, пипетка вместимостью 10 мл, стеклянная палочка, рН-метр-милливольтметр, фильтровальная бумага.
Методика работы
Сущность метода потенциометрического титрования состоит в том, что точка эквивалентности (т.э.) находится по резкому изменению потенциала индикаторного электрода, чувствительного к титруемым ионам. В начале титрования потенциал индикаторного электрода изменяется медленно, но вблизи точки эквивалентности потенциал индикаторного электрода изменяется скачком при добавлении нескольких капель титрующего раствора.
При потенциометрическом титровании кислот нет необходимости вычислять потенциал индикаторного электрода. Интегральные и дифференциальные кривые титрования можно начертить по результатам измерения ЭДС гальванического элемента или рН раствора. Для определения их значений удобно воспользоваться рН-метром. В качестве индикаторного электрода в приборе pH-340 (см. рисунок в теме 6) служит стеклянный электрод, а в качестве электрода сравнения – хлорсеребряный.
Порядок измерения pH на приборе pH-340 описан в теме 6 «Буферные растворы».
При использовании прибора рН-метра как милливольтметра следует иметь в виду, что в приборе предусмотрена возможность измерения электродвижущихся сил различной полярности. При отсчете показаний на участке шкалы от 0 до 1400 мВ знак, соответствующий положению ручки переключателя «Род работы» в момент измерения, соответствует знаку потенциала индикаторного (измерительного) электрода. Показания, отсчитанные на любом диапазоне измерения, необходимо умножить на 100.
Примеры:
1. Переключатель диапазонов установлен в положение
«11–14», а стрелка показывающего прибора установилась на значении 0,25. Измеренное значение ЭДС: (11+0,25)100 =
= 11,25·100 = 1125 мВ.
2. Переключатель диапазонов установлен в положении
«–1–4», стрелка показывающего прибора установилась на значении 0,25. Измеренное значение ЭДС: (–1+0,25)100 =
= –0,75·100 = –75 мВ.
В химический стакан для титрования наливают 10 мл исследуемого раствора кислоты (НСl концентрации ~0,1 моль/л), а бюретка с делением не более 0,1 мл заполняется титрованным раствором NаОН концентрации 0,1 моль/л.
Электроды рН-метра погружают в исследуемый раствор и измеряют ЭДС гальванического элемента или рН. Измерение ЭДС гальванического элемента начинают, приливая в раствор кислоты по 1 мл щелочи из бюретки. Перемешивают раствор и через 2–3 мин вновь измеряют ЭДС. Продолжают приливать по 1 мл щелочи и измерять ЭДС, пока общий объем прилитой щелочи не достигнет 7 мл. При приближении к точке эквивалентности, когда суммарный объем прибавленной щелочи достигнет 8 мл, следует прибавлять по 0,2 мл раствора щелочи. Максимальное изменение ЭДС указывает на то, что точка эквивалентности достигнута. После точки эквивалентности опыт не прекращают, а продолжают титрование, добавляя по 0,5 мл щелочи 2–3 раза. При добавлении порции титранта после точки эквивалентности наблюдается скачок потенциала.
Результаты титрования заносят в табл. 7.3.
Таблица 7.3
Результаты эксперимента
| Номер опыта | Объем добавленной щелочи Vщ, мл | DV, мл | Е, мВ, или рН | DЕ, мВ, или DрН | DЕ/DV, мВ/мл , или DрН/DV, мл – 1 |
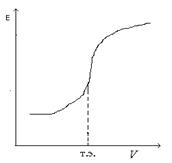 Рис. 7.3. Интегральная кривая потенциометрического титрования Рис. 7.3. Интегральная кривая потенциометрического титрования 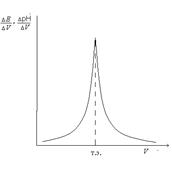 Рис. 7.4. Дифференциальная кривая потенциометрического титрования Рис. 7.4. Дифференциальная кривая потенциометрического титрования | По полученным данным строят интегральную кривую титрования (рис. 7.3). ЭДС гальванического элемента Е (ось ординат) – объем прибавленного титранта V (ось абсцисс). По перегибу кривой определяют точку эквивалентности (т.э.), которая соответствует объему титранта, израсходованного на титрование. Чтобы определить точку эквивалентности более точно, строят дифференциальную кривую титрования (рис. 7.4). Для построения кривой на оси ординат откладывают отношение изменения ЭДС DЕ соответствующему изменению объема прибавляемой щелочи DV, а на оси абсцисс – объём добавленной щелочи Vщ. Точку эквивалентности можно также найти, измеряя рН после каждой прибавленной порции щелочи и построив график |
зависимости в координатах DрН/DV – Vщ.
Определив объем раствора щелочи, израсходованного для полной нейтрализации данного объема раствора кислоты, рассчитывают ее концентрацию по формуле
Скисл = Сщ Vщ. т. э/ Vкисл,
где Сщ – концентрация щелочи; Vщ. т. э – объем добавленной щелочи в точке эквивалентности; Vкисл – объем кислоты (10 мл).
Вопросы для самостоятельной подготовки и контроля
1. Укажите причину возникновения скачка потенциала на границе металл – раствор.
2. Что понимают под электродным потенциалом? Относительно какого электрода его измеряют?
3. Какую роль выполняют стандартные электроды сравнения? Назовите типы электродов.
4. Что такое ЭДС гальванического элемента? На чем основан компенсационный метод измерения ЭДС?
5. Какие электроды называют окислительно-восстанови-тельными?
6. Что такое окислительно-восстановительный потенциал?
7. Редокс-потенциал. Какие факторы влияют на его значение?
8. Хингидронный электрод. Приведите электрохимическую схему окислительно-восстановительной реакции, протекающей при его работе. Для каких измерений он используется?
9. В чем сущность потенциометрического метода определения рН?
10. Какие индикаторные электроды применяют для определения рН?
11. В чем преимущества стеклянного электрода? Какова его конструкция?
12. В чем заключается потенциометрическое титрование?
13. Как строятся интегральная и дифференциальная кривые потенциометрического титрования?
Тема 8. Кондуктометрия
