Существенным недостатком гравиметрического метода является длительность определений.
Гравиметрические факторы, называемые также аналитическими множителями или факторами пересчета, вычисляют как отношение молекулярной массы определяемого компонента к молекулярной массе гравиметрической формы с учетом стехиометрических коэффициентов. Их значения обычно приводят в справочниках.
2. Для приготовления титрованного раствора соды взяли навеску 1,5250 г Na2CO3, растворили ее в мерной колбе и разбавили раствор водой до объема 250 мл. Вычислить титр полученного раствора (г/мл).
Билет № 23
1. Требования к осаждаемой и гравиметрической формам осадка, к осадителю. Расчет количества осадителя.
Реагент-осадитель, осаждаемая и гравиметрическая формы должны отвечать определенным требованиям. Определяемый компонент должен осаждаться по возможности более полно, при этом остальные компоненты должны оставаться в растворе. Необходимо, чтобы осаждаемая форма легко и полностью превращалась в гравиметрическую, а последняя имела бы строго постоянный, точно известный химический состав и была бы устойчива на воздухе. Для уменьшения погрешностей анализа желательно, чтобы гравиметрическая форма имела возможно большую молярную массу, а содержание определяемого элемента в молекуле было меньшим. Эти требования могут быть выполнены путем правильного выбора реагента-осадителя, условий осаждения, фильтрования, промывания и прокаливания осадка.
2. Имеется 0,1046 моль-экв/л раствор HCl. Определить молярную концентрацию этого раствора, если известно, что раствор используется при титровании соды (Na2CO3).
Билет № 24
1. Сущность титриметрического анализа. Классификация методов. Требования к реакциям, используемым в титриметрии.
Титриметрический анализ основан на точном измерении количества реактива, израсходованного на реакцию с определяемым веществом. Еще недавно этот вид анализа обычно называли объемным в связи с тем, что наиболее распространенным в практике способом измерения количества реактива являлось измерение объема раствора, израсходованного на реакцию. Сейчас под объемным анализом понимают совокупность методов, основанных на измерении объема жидкой, газовой или твердой фаз.
. Обычно выделяют следующие методы титриметрического анализа.
1. Методы кислотно-основного взаимодействия связаны с процессом передачи протона:
2. Методы комплексообразования используют реакции образования координационных соединений:
3. Методы осаждения основаны на реакциях образования малорастворимых соединений:
4. Методы окисления - восстановления объединяют многочисленную группу окислительно-восстановительных реакций:
Реакции, применяемые в титриметрии, должны удовлетворять следующим основным требованиям:
1) реакция должна протекать количественно, т.е. константа равновесия реакции должна быть достаточно велика;
2) реакция должна протекать с большой скоростью;
3) реакция не должна осложняться протеканием побочных реакций;
4) должен существовать способ определения окончания реакции.
2. На титрование 10,00 мл раствора KOH затрачено 15,50 мл 0,1028 М раствора HCl. Вычислить молярную концентрацию раствора KOH.
Билет № 25
1. Способы выражения концентрации растворов. Расчеты в титриметрическом методе анализа.
а. Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах.
б. Объёмная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах.
в. Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности».
г. Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
д. Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы
е. Моляльность — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности».
ж. Титр раствора — масса растворённого вещества в 1 мл раствора.
з. Весообъёмные проценты.Соответствуют отношению массы одной части вещества (например, 1 г) к 100 частям объёма раствора (например, к 100 мл).[1] Этот способ выражения используют, например, в спектрофотометрии, если неизвестна молярная масса вещества или если неизвестен состав смеси, а также по традиции в фармакопейном анализе. и др.
Расчеты в титриметрии.Все расчеты в титриметрии связаны с законом эквивалентов и понятием эквивалент. Эквивалентом называют реальную или условную частицу вещества, которая в данной реакции равноценна (эквивалентна) одному иону водорода или одному электрону. Например, эквивалент NaOH, НСl, NaCl - реальная частица, соответствующая молекуле этих веществ. Эквивалент Н3PO4 , в зависимости от числа участвующих в реакции протонов, может представлять реальную молекулу Н3PO4 и условную часть молекулы: 1/2Н3PO4 или 1/3Н3PO4. Дробь, показывающую, какая часть молекулы или иона является эквивалентом, называют фактором эквивалентности fэкв. Фактор эквивалентности рассчитывают на основе стехиометрии реакции. Число, показывающее, сколько эквивалентов содержится в молекуле, называют числом эквивалентности и обозначают z*: fэкв = 1/z*. Молярная масса эквивалента вещества - это масса одного моля эквивалента этого вещества, равная произведе-нию фактора эквивалентности на молярную массу вещества. На-пример, для вещества В:
М(fэкв В) = fэкв(В) * М(В) = 1/z*(В)*М(В)
2. Вычислить pH раствора, в котором содержится 0,63 г HNO3.
Решение:
Рассчитаем молярную концентрацию HNО3:
с=m/M*V ; V = 1 л
M(HNО3) = 1+ 14 + 3  16 = 63 г/ моль; c(HNО3) = 0,63/ 63 = 0,01 моль/л; pH = -lg[H+] = -lg(10-2) = 2.
16 = 63 г/ моль; c(HNО3) = 0,63/ 63 = 0,01 моль/л; pH = -lg[H+] = -lg(10-2) = 2.
Ответ: рН = 2.
Билет № 26
1. Основные понятия титриметрии: фактор эквивалентности, молярная масса эквивалента, молярная концентрация эквивалента. Эквивалент. Фактор эквивалентности. Во многих химических реакциях принимает участие не целая частица вещества, а лишь ее часть - эквивалент. Вещества реагируют между собой эквивалентами — этот закон кратных отношений Дальтона в аналитической химии служит основой всех количественных расчетов, особенно в титриметрических методах анализа.
Фактор эквивалентности - число, обозначающее, какая доля реальной частицы вещества X эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции. Фактор эквивалентности - безразмерная величина, причем fэкв < 1 .
Молярная масса эквивалента вещества(А) может быть выражена произведением фактора эквивалентности вещества А на его молярную массу:
Мэ (А) = fэкв (А) 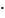 М(А), г
М(А), г 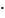 моль-1.
моль-1.
Молярная концентрация эквивалента вещества А(сэ(А)) ранее называемая "нормальной" ("н"), выражается количеством моль-эквивалентов, содержащихся в 1 л раствора (моль*экв/л) и находится по формуле
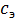 (A) =
(A) = 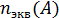 /V=m/
/V=m/ 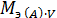
Где nэкв(А) – число молей эквивалента вещества А.
2. Рассчитать pH раствора, в 1 л которого содержится 0,4 г гидроксида натрия (NaOH). Решение:
Найдем молярную массу NaOH и молярную концентрацию раствора NaOH: M(NaOH) = 23 + 16+ 1 = 40 г /моль; V = 1л;
С=m/M*V c(NaOH) = 0,4 / 40 = 0,01 моль/л.
рОН = -lg [ОН-] = -lg(10-2) = 2 рН = 14 - 2 = 12.
Ответ: рН = 12.
Билет № 27
1. Методы обнаружения конечной точки титрования (КТТ). Основные принципы метода. Индикаторы. Интервал перехода окраски. Безындикаторные способы.Хлорид - ионы определяют по так называемому способу равного помутнения (метод Гей-Люссака). Бромид- и йодид- ионы определяют безындикаторным способом просветления. Из современных безындикаторных методов в аргентометрии чаще всего применяется потенциометрическое определение точки эквивалентности с использованием серебряных или галогенид-селективных электродов.
Индикаторные способы.Дляопределения конечной точки титрования используют различные индикаторы, в частности адсорбционные. Адсорбционными индикаторами обычно называют вещества обратимо изменяющие свою окраску на поверхности осадка, образующегося во время титрования. Ионы индикатора, являющегося кислотным или основным красителем, замещают однозначные с ними ионы наружного двойного слоя частиц. В результате поляризационного взаимодействия электронные оболочки ионов индикатора деформируются потенциалопределяющими ионами, что приводит к изменению окраски.
| Показатель титрования рТ | Область перехода рН |
| Метиловый оранжевый 4,0 | 3,1 - 4,4 |
| Метиловый красный 5,5 | 4,4 - 6,2 |
| Лакмус 7,0 | 5,0 - 8,0 |
| Фенолфталеин 9,0 | 8,0 - 10 |
2. Вычислить pH 0,001 М раствора HCl.
Решение: С(HCl)= [H+]=0,001M
pH = -lg[H+] = -lg(10-3) = 3
Ответ: рН = 3
Билет № 28
1. Комплексонометрическое титрование. Сущность метода. Прямое и обратное титрование. Примеры. Металлохромные индикаторы.
Комплексонометрия (трилонометрия) - титриметрический метод анализа, основанный на реакциях взаимодействия комплексонов (чаще всего трилона Б), катионами щелочноземельных и тяжелых металлов, которые приводят к образованию растворимых в воде бесцветных прочных внутрикомплексных соединений. Трилон Б (комплексон III) образует внутрикомплексные соединения с катионами металлов за счет валентных связей с карбоксильными группами, вытесняя из них атомы водорода, а также за счет координационных связей ионов-комплексообразователей с атомами азота. При комплексонометрическом титровании к анализируемому раствору прибавляют металлоиндикатор, который образует с определяемыми катионами комплекс, имеющий определенную окраску. В процессе титрования трилоном Б комплекс катионов металла с индикатором разрушается и образуется бесцветный, очень прочный комплекс катионов с трилоном Б, а в раствор переходят ионы свободного индикатора:
[Ме Ind] - + H2L2 - ↔ [MeL]2 - + H2Ind -
(окраска 2) (окраска 1)
Конечную точку титрования определяют по собственной окраске индикатора (окраска 1).
Прямое титрование. К анализируемому раствору прибавляют аммиачный буферный раствор, металлоиндикатор и титруют стандартным раствором трилона Б. Способом прямого титрования определяют катионы Cu2+, Со2+, Pb2+, Ni2+, Zn2+, Fе3+, Ва2+, Сг3+,Ca2+, Mg2+ и т. д.
Обратное титрование. К анализируемому раствору прибавляют аммиачный буферный раствор, затем точно отмеренный удвоенный минимальный объем (35,00-40,00 см3) стандартного раствора трилона Б, который вступает в реакцию с определяемыми ионами, а его избыток оттитровывают стандартным раствором магния сульфата или цинка сульфата в присутствии металлоиндикатора. При этом протекают реакции:
Ме2+ + H2L2- ↔ [Ме]2- + 2Н+
изб. H2L2- + Zn2+ ↔ [ZnL] 2- + 2Н+
При комплексонометрическом титровании используют металлохромные индикаторы (металлоиндикаторы). Металлоиндикаторы - это органические красители (мурексид, эриохром черный Т, эриохром сине-черный Б, цинкон и др.), которые образуют с определяемыми ионами растворимые в воде окрашенные комплексные соединения, менее прочные, чем комплекс катиона металла с трилоном Б.
2. Сколько моль NaOH содержится в 0,5 л раствора, pH которого равно 12.
pH = -lg[H+] =14 -lg(OH) = 12
14-2=2=-lg(OH) C(OH)=0,01 M
Билет № 29
1. Определение общей жесткости комплексонометрическим титрованием.
Жесткость воды выражают числом миллиграмм-эквивалентов кальция и магния.Определение общей жесткости проводят путем комплексонометрического титрования раствором комплексона III в присутствии эриохром черного или хром темно-синего. Обычно определяют суммарное количество кальция и магния. При необходимости раздельного определения кальция и магния сначала определяют суммарное их количество. Затем в отдельной пробе осаждают кальций в виде оксалата кальция и оттитровывают ионы магния. Кальциевую жесткость определяют по разности. В присутствии некоторых примесей ход анализа изменяется. Ионы меди и цинка переводят в сульфиды, чтобы марганец не окислялся, прибавляют гидроксиламин.
2. Рассчитать pH раствора, в 1 которого содержится 0,98 г H2SO4.
С=m/M*V C(H2SO4)=0,98/98*1=0,01 моль/л
C(H2SO4)=2[H+]=0,02моль/л pH = -lg[H+] = -lg(0,02) = 1,7
Билет № 30
1. Метод ОВ титрования. ОВ пара. ОВ полуреакция. Уравнение Нернста.
Методы окислительно-восстановительного титрования основаны на использовании реакций, связанных с переносом электронов, то есть окислительно-восстановительных процессов.
Методы окислительно-восстановительного титрования пригодны для определения многих органических соединений, в том числе фармацевтических препаратов, подавляющее большинство которых являются потенциальными восстаноометриювителями.
В зависимости от используемого титранта различают перманганатометрию, йодометрию, дихроматометрию, броматометрию. В этих методах в качестве стандартных растворов применяют соответственно KMnO4, I2, K2Cr2O7, KBrO3 и т.д. Таким образом, любая ОВР, записанная в общем виде
aOx1 + bRed2 = aRed1 + bOx2
Может быть представлена в виде двух полуреакций:
Ox1 + b 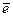 = Red1
= Red1
Red2 – а 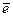 = Ox2
= Ox2
Исходная частица и продукт каждой полуреакции составляют ОВ пару. Например, в реакции окисления железа(II) перманганатом калия участвуют две ОВ пары: Fe3/Fe2+ и MnO4-/Mn2+.
В процессе титрования по методу окисления-восстановления происходит изменение ОВ потенциалов взаимодействующих систем. Если условия отличаются от стандартных, т.е. активности потенциалопределяющих ионов не равны 1 (а≠1), равновесный потенциал ОВ полуреакции aOx1 + n 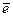 = bRed1 может быть рассчитан по уравнению Нернста:
= bRed1 может быть рассчитан по уравнению Нернста:
EOx1/ Red1 = Eº + 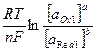 ,
,
R – универсальная газовая константа (8,314 Дж/моль∙град., F – постоянная Фарадея (9,6585 кл/моль), Е – ОВ потенциал системы, Еº - стандартный ОВ потенциал.
Если подставить значения постоянных величин, Т = 298 К (т.е. 25 ºС) и заменить натуральный логарифм на десятичный, а активности – на концентрации, то уравнение Нернста примет следующий вид:
EOx1/ Red1 = Eº + 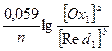 .
.
2. Вычислить pH 0,015 М раствора KOH.
С(KOH)= [ОН-]=0,015
pH=14-lg0,015=14-1,8=12,2
Билет № 31
1. Особенности реакций, используемых в ОВ титровании. Способы фиксирования точки эквивалентности.
Способы фиксирования конечной точки титрования. При комплексонометрическом титровании используют металлохромные индикаторы (металлоиндикаторы). Металлоиндикаторы - это органические красители (мурексид, эриохром черный Т, эриохром сине-черный Б, цинкон и др.), которые образуют с определяемыми ионами растворимые в воде окрашенные комплексные соединения, менее прочные, чем комплекс катиона металла с трилоном Б.
2. Дописать уравнение реакции, расставить коэффициенты, вычислить факторы эквивалентности реагирующих веществ:
HNO3 + Fe(OH)3 → ……………….
Билет № 32
1. Физико-химические методы анализа.
Физико-химические или инструментальные методы анализа основаны на измерении с помощью приборов (инструментов) физических параметров анализируемой системы, которые возникают или изменяются в ходе выполнения аналитической реакции.
В основу классификации физико-химических методов анализа положена природа измеряемого физического параметра анализируемой системы, величина которого является функцией количества вещества. В соответствии с этим все физико-химические методы делятся на три большие группы:
- электрохимические;
- оптические и спектральные;
- хроматографические.
2. С помощью электронного баланса расставить коэффициенты, определить факторы эквивалентности (fэ) реагирующих веществ:
FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
Билет № 33
1. Оптические (эмиссионный спектральный анализ, фотометрия пламени, люминесцентный анализ, спектрофотометрия, фотометрия и др.).
