Окислительно-восстановительные потенциалы
Для реакций, протекающих в растворах электролитов мерой окислительно-восстановительных способностей веществ служат их окислительно-восстановительные потенциалы (ОВП). ОВП характеризуют процесс превращения веществ из окисленной формы [Ох] в восстановленную [Red] и выражают равновесие между окисленной и восстановленной формами и их называют полуреакции:
[Ох] [Red] Е°, В ОЭО
F + 2е → 2Fˉ 2,850 4,0
Cl + 2е → Cl 1,358 3,0
Br+ 2е →Br 1,066 2,8
I + 2е → I 0,540 2,5
Чем больше алгебраическая величина стандартного ОВП элемента, тем сильнее выражены его окислительные свойства.
Чем меньше алгебраическая величина стандартного ОВП элемента. тем сильнее выражены его восстановительные свойства.
Условие протекания окислительно-восстановительного процесса
Условием протекания окислительно-восстановительного процесса
является неравенство ΔG< 0. Между энергией Гиббса и ОВП существует связь: ΔG = - nF Δ Е.
Следовательно, окислительно-восстановительный процесс протекает самопроизвольно в том случае, если разность ОВП будет положительная (>0), т.е. Δ Е>0, где Δ Е = ЭДС = Е ок. – Е восст.
Пример: Будет ли катион Fe окислять анион Cl?
Решение: Е = 0,77 В, а Е = 1,36 В. ЭДС = Δ Е = Е ок. – Е восст. = 0,77 – 1,36 = - 0,59 В. Так как ЭДС <0, то реакция невозможна.
Когда мы рассматриваем ОВР, то учитываем, что это единый окислительно-восстановительный процесс, состоящий из полуреакций окисления и восстановления.
Зависимость ОВП от концентрации веществ, участвующих в процессе, выражается уравнением Нернста:
Е = Е + 0,059/n lg С oх - С red
Составление уравнений
Если ЭДС окислительно-восстановительной реакции, рассчитанная как сумма стандартных электрохимических потенциалов восстановления и окисления, положительна, то такая реакция протекает самопроизвольно. Для составления уравнения окислительно-восстановительной реакции, протекающей в водном растворе, удобно использовать метод электронно-ионного баланса. В этом методе сначала составляют по отдельности уравнения реакций окисления и восстановления, а затем их объединяют в уравнение окислительно-восстановительной реакции. При составлении частных полуреакций используются молекулы воды, а также ионы водорода и гидроксида. При рН < 7 используют Н, Н О. а при рН> 7 – ОНˉ , Н О.
1.Рассмотрим реакцию взаимодействия перманганата калия KMnО4 с сульфитом натрия Nа2SО3 в кислой среде.
В кислой среде перманганат-ион, окрашенный в фиолетово-красный цвет, обесцвечивается, восстанавливаясь до двухвалентного марганца:
KMnO4 + Na2SO4 + H2SO4 =


При подборе коэффициентов окислительно-восстановительных реакций уравнивание атомов кислорода осуществляется при помощи молекул воды (или гидроксид-ионов в щелочных средах).
В щелочной среде продуктом восстановления перманганат-иона(МnО4-) является манганат-ион (МnО4-), окрашенный в зеленый цвет.

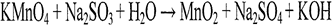

В нейтральной среде образуется бурый осадок диоксида марганца МnО2.
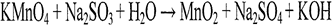
2.Зная значения стандартных электрохимических потенциалов E0, можно рассчитать ЭДС реакции при стандартных условиях. Если уравнение электродного процесса переписывается в противоположном направлении окисления-восстановления, то знак потенциала (как и знак ЭДС) изменяется на противоположный.
Сравнивая уравнения двух полуреакций, выписанных из таблицы стандартных электродных потенциалов, видно, что первое уравнение относится к электродному процессу, обладающему более высокой способностью к приему электронов (большее положительное и меньшее отрицательное значение потенциала). Перманганат-ион - окислитель. Уравнение оставляем без изменений. Второе уравнение, как имеющее более низкий электродный потенциал, обладает большей способностью отдавать электроны, его переписываем в противоположном направлении. Сульфит-ионы-восстановители.
Суммируем оба уравнения:

Положительное значение ЭДС свидетельствует о возможности прохождения процесса при стандартных условиях.
Все соединения шестивалентного хрома - активные окислители, особенно в кислой среде.
Продуктами восстановления при этом являются трехвалентные соединения хрома:
в кислой среде: Cr2O72-+14H++6e-=2Cr3++7H2O
Лабораторная работа №9
