Периодическая система Д. И. Менделеева
Вопрос
Периодический закон Д.И. Менделеева
Периодический закон – величайшее достижение химической науки, основа всей современной химии. С его открытием химия перестала быть описательной наукой, в ней стало возможным научное предвидение.
Периодический закон открыт Д. И. Менделеевымв 1869 г. Ученый сформулировал этот закон так: «Свойства простых тел, также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов».
Более детальное изучение строения вещества показало, что периодичность свойств элементов обусловлена не атомной массой, а электронным строением атомов.
Заряд ядра является характеристикой, определяющей электронное строение атомов, а следовательно, и свойства элементов. Поэтому в современной формулировке Периодический закон звучит так:свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от порядкового номера (от величины заряда ядра их атомов).
Выражением Периодического закона является периодическая система элементов.
Периодическая система Д. И. Менделеева
Периодическая система элементов Д. И. Менделеева состоит из семи периодов, которые представляют собой горизонтальные последовательности элементов, расположенные по возрастанию заряда их атомного ядра. Периоды 1, 2, 3, 4, 5, 6 содержат соответственно 2, 8, 8, 18, 18, 32 элемента. Седьмой период не завершен. Периоды 1, 2 и 3 называют малыми,остальные - большими.
Каждый период (за исключением первого) начинается атомами щелочных металлов (Li, Na, К, Rb, Cs, Fr) и заканчивается благородным газом (Ne, Ar, Kr, Xe, Rn), которому предшествует типичный неметалл. В периодах слева направо постепенно ослабевают металлические и усиливаются неметаллические свойства, поскольку с ростом положительного заряда ядер атомов возрастает число электронов на внешнем уровне.
В первом периоде, кроме гелия, имеется только один элемент - водород. Его условно размещают в IA или VIIA подгруппе, так как он проявляет сходство и со щелочными металлами, и с галогенами. Сходство водорода со щелочными металлами проявляется в том, что водород, как и щелочные металлы является восстановителем и, отдавая один электрон, образует однозарядный катион. Больше общего у водорода с галогенами: водород, как и галогены неметалл, его молекула двухатомна, он может проявлять окислительные свойства, образуя с активными металлами солеподобные гидриды, например, NaH, CaH2.
В четвертом периоде вслед за Са расположены 10 переходных элементов (декада Sc - Zn), за которыми находятся остальные 6 основных элементов периода (Ga - Кг). Аналогично построен пятый период. Понятие переходный элементобычно используется для обозначения любого элемента с валентными d– или f–электронами.
Шестой и седьмой периоды имеют двойные вставки элементов. За элементом Ва расположена вставная декада d–элементов (La - Hg), причем после первого переходного элемента La следуют14 f–элементов - лантаноидов( Се - Lu). После Hg располагаются остальные 6 основных р-элементов шестого периода (Тl - Rn).
В седьмом (незавершенном) периоде за Ас следуют 14 f–элементов- актиноидов(Th - Lr). В последнее время La и Ас стали причислять соответственно к лантаноидам и актиноидам. Лантаноиды и актиноиды помещены отдельно внизу таблицы.
Таким образом, каждый элемент в периодической системе занимает строго определенное положение, которое отмечается порядковым,или атомным,номером.
В периодической системе по вертикали расположены восемь групп (I – VIII), которые в свою очередь делятся на подгруппы - главные,или подгруппы А и побочные,или подгруппы Б. Подгруппа VIIIБ-особая, она содержит триадыэлементов, составляющих семейства железа (Fе, Со, Ni) и платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
Сходство элементов внутри каждой подгруппы - наиболее заметная и важная закономерность в периодической системе. В главных подгруппах сверху вниз усиливаются металлические свойства и ослабевают неметаллические. При этом происходит увеличение устойчивости соединений элементов в низшей для данной подгруппы степени окисления. В побочных подгруппах – наоборот – сверху вниз металлические свойства ослабевают и увеличивается устойчивость соединений с высшей степенью окисления.
2.вопрос
Строение атомов химических элементов. Состав атомного ядра. Строение электронных оболочек атомов первых 20 химических элементов периодической системы Д. И. Менделеева
Атом — наименьшая частица вещества, неделимая химическим путем. В XX веке было выяснено сложное строение атома. Атомы состоят из положительно заряженного ядра и оболочки, образованной отрицательно заряженными электронами. Общий заряд свободного атома* равен нулю, так как заряды ядра и электронной оболочки уравновешивают друг друга. При этом величина заряда ядра равна номеру элемента в периодической таблице (атомному номеру) и равна общему числу электронов (заряд электрона равен −1).
Атомное ядро состоит из положительно заряженных протонов и нейтральных частиц — нейтронов, не имеющих заряда. Обобщенные характеристики элементарных частиц в составе атома можно представить в виде таблицы:
| Название частицы | Обозначение | Заряд | Масса |
| протон | p | +1 | |
| нейтрон | n | ||
| электрон | e− | −1 | принимается равной 0 |
Число протонов равно заряду ядра, следовательно, равно атомному номеру. Чтобы найти число нейтронов в атоме, нужно от атомной массы (складывающейся из масс протонов и нейтронов) отнять заряд ядра (число протонов).
Например, в атоме натрия 23Na число протонов p = 11, а число нейтронов n = 23 — 11 = 12
Число нейтронов в атомах одного и того же элемента может быть различным. Такие атомы называют изотопами.
Электронная оболочка атома также имеет сложное строение. Электроны располагаются на энергетических уровнях (электронных слоях).
Номер уровня характеризует энергию электрона. Связано это с тем, что элементарные частицы могут передавать и принимать энергию не сколь угодно малыми величинами, а определенными порциями — квáнтами. Чем выше уровень, тем большей энергией обладает электрон. Поскольку чем ниже энергия системы, тем она устойчивее (сравните низкую устойчивость камня на вершине горы, обладающего большой потенциальной энергией, и устойчивое положение того же камня внизу на равнине, когда его энергия значительно ниже), вначале заполняются уровни с низкой энергией электрона и только затем — высокие.
Максимальное число электронов, которое может вместить уровень, можно рассчитать по формуле:
N = 2n2, где N — максимальное число электронов на уровне,
n — номер уровня.
Тогда для первого уровня N = 2 · 12 = 2,
для второго N = 2 · 22 = 8 и т.д.
Число электронов на внешнем уровне для элементов главных (А) подгрупп равно номеру группы.
В большинстве современных периодических таблиц расположение электронов по уровням указано в клеточке с элементом. Очень важно понимать, что уровни читаются снизу вверх, что соответствует их энергии. Поэтому столбик цифр в клеточке с натрием :
1
8
2
следует читать так:
на 1-м уровне — 2 электрона,
на 2-м уровне — 8 электронов,
на 3-м уровне — 1 электрон
Будьте внимательны, очень распространенная ошибка!
Распределение электронов по уровням можно представить в виде схемы:
11Na ) ) )
2 8 1
Если в периодической таблице не указано распределение электронов по уровням, можно руководствоваться:
· максимальным количеством электронов: на 1-м уровне не больше 2 e−,
на 2-м — 8 e−,
на внешнем уровне — 8 e−;
· числом электронов на внешнем уровне (для первых 20 элементов совпадает с номером группы)
Тогда для натрия ход рассуждений будет следующий:
1. Общее число электронов равно 11, следовательно, первый уровень заполнен и содержит 2 e−;
2. Третий, наружный уровень содержит 1 e− (I группа)
3. Второй уровень содержит остальные электроны: 11 − (2 + 1) = 8 (заполнен полностью)
* Ряд авторов для более четкого разграничения свободного атома и атома в составе соединения предлагают использовать термин «атом» только для обозначения свободного (нейтрального) атома, а для обозначения всех атомов, в том числе и в составе соединений, предлагают термин «атомные частицы». Время покажет, как сложится судьба этих терминов. С нашей точки зрения, атом по определению является частицей, следовательно, выражение «атомные частицы» можно рассматривать как тавтологию («масло масляное»).
3.вопрос
Атом- мельчайшая электронейтральная частица химического элемента, сохраняющая его свойства.
Атомная единица массы (а. е. м.)- 1/12 часть абсолютной массы атома углерода.
Молекула- наименьшая частица вещества, сохраняющая его химические свойства.
Относительная атомная масса элемента -число, показывающее, во сколько раз масса атома данного элемента больше 1/12 массы атома углерода.
Относительная молекулярная масса вещества -число, показывающее, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода.
Моль - количество вещества, содержащее столько же частиц (атомов, молекул или других), сколько содержится атомов углерода в 0,012 кг (12 г) углерода.
Моль - количество вещества, содержащее 6,02х 1023 молекул, атомов или других частиц.
Число na — 6,02х 1023 моль-1 называется постоянной Авогадро.
Абсолютную массу молекулывещества В можно рассчитать по уравнению: тв = Мв /NA, где Мв - молярная масса вещества В.
Эквивалентом элемента (Э) называют такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Эквивалент элемента Э можно вычислить, исходя из его атомной массы А и валентности В по формуле Э = А/В. Например, эквивалент кислорода равен 8, так как валентность кислорода всегда равна двум: Э0 = 16/2 = 8.
Масса 1 эквивалента элемента называется его эквивалентной массой.
Эквиваленты выражаются в молях, а эквивалентные массы — в г/моль.
Эквивалент не является постоянной величиной, а зависит от валентности элемента в том или ином соединении. Например, в соединениях NH3, H2S и НСl эквивалент (Э) и эквивалентная масса (тэ) азота, серы и хлора равны Э(N) - 1/3 моль; Э(S) - 1/2 моль; Э(Сl) = 1 моль и mэ(N) = 1/3 х 14 = 4,67 г/моль; mЭ(S) = 1/2 х 32 = 16 г/моль; тЭ(Cl) = 1 х 35,5 = 35,5 г/моль. В соединении SO2 сера четырёхвалентна и её эквивалентная масса равна тэ(S) = 64/4=16 г/моль.
Эквивалент оксида, основания, кислоты и соли:
Эоксида = Mоксида /(число атомов элемента х валентность элемента);
Эоснования = Моснования / кислотность основания;
Экислоты = Мкислоты / основность кислоты;
Эсоли = Мсоли /(число атомов металла х валентность металла), где М— мольная масса соединений.
Например, Э(А12О3) = 102/(2x3) = 17; Э(А1(ОН)3) = 78/3 = 26; Э(Н2S04) = 98/2 = 49; Э(А12(SО4)3) =342 /(2x3) = 57.
4.вопрос
Образование химических соединений обусловлено возникновением химической связи между атомами в молекулах и кристаллах.
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения.
Появление атомной модели Бора, впервые объяснившей строение электронной оболочки, способствовало созданию представления о химической связи и её электронной природе. В соответствии с моделью Бора электроны могут занимать в атоме положения, которым отвечают определенные энергетические состояния, т. е. энергетические уровни. В 1915г. немецкий физик Коссель дал объяснение химической связи в солях, а в 1916 году американский учёный Льюис предложил трактовку химической связи в молекулах. Они исходили из представлений о том, что атомы элементов обладают тенденцией к достижению электронной конфигурации благородных газов (полного заполнения внешнего электронного слоя). Представления Косселя и Льюиса получили названия электронной теории валентности.
Валентность элементов главных подгрупп Периодической системы зависит от числа электронов, находящихся на внешнем электронном слое. Поэтому эти внешние электроны принято называть валентными. Для элементов побочных подгрупп в качестве валентных электронов могут выступать как электроны внешнего слоя, так и электроны внутренних подуровней.
Различают три основных типа химической связи: ковалентную, ионную, металлическую.
Таблица.Типы химической связи и их основные отличительные признаки.
| Химическая связь | Связываемые атомы | Характер элементов | Процесс в электронной оболочке | Образующиеся частицы | Кристаллическая решетка | Характер вещества | Примеры |
| Ионная | Атом металла и атом неметалла | Электроположительный и электро отрицательный | Переход валентных электронов | Положительные и отрицательные ионы | Ионная | Солеобразный | NaCl CaO NaOH |
| Ковалентная | Атомы неметаллов (реже-атомы металлов) | Электроотрицательный реже электроположительный | Образование общих электронных пар, заполнение молекулярных орбиталей | Молекулы | Молекулярная | Летучий или нелетучий | Br2 CO2C6H6 |
| --------- | Атомная | Алмазоподоб ный | Алмаз Si SiC | ||||
| Металличес кая | Атомы металлов | Электроположительный | Отдача валентных электронов | Положительные ионы и электронный газ | Металлическая | Металлическая | Металлы и сплавы |
КОВАЛЕНТНАЯ СВЯЗЬ.
Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов.
| Она может быть образована атомами одного итого же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H2, O2, N2, Cl2 и др. |
| Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная; например, такая ковалентная связь существует в молекулах H2O, NF3, CO2. Ковалентная связь образуется между атомами элементов, обладающих электроотрицательным характером. |
Неоходимо ввести понятие электроотрицательность. Электроотрицательность - это способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи.

ряд электроотрицательностей
Относительные электроотрицательности элементов (по Полингу)
| группа | I | II | III | IV | V | VI | VII | VIII | |||
| период | |||||||||||
| H 2,1 | He - | ||||||||||
| Li 0,97 | Be 1,47 | B 2,01 | C 2,50 | N 3,07 | O 3,5 | F 4,10 | Ne - | ||||
| Na 1,01 | Mg 1,23 | Al 1,47 | Si 1,74 | P 2,1 | S 2,6 | Cl 2,83 | Ar - | ||||
| K 0,91 | Ca 1,04 | Sc 1,20 | Ti 1,32 | V 1,45 | Cr 1,56 | Mn 1,60 | Fe 1,64 | Co 1,70 | Ni 1,75 | ||
| Cu 1,75 | Zn 1,66 | Ga 1,82 | Ge 2,02 | As 2,20 | Se 2,48 | Br 2,74 | Kr - | ||||
| Rb 0,89 | Sr 0,99 | Y 1,11 | Zr 1,22 | Nb 1,23 | Mo 1,30 | Tc 1,36 | Ru 1,42 | Rh 1,45 | Pd 1,35 | ||
| Ag 1,42 | Cd 1,46 | In 1,49 | Sn 1,72 | Sb 1,82 | Te 2,01 | I 2,21 | Xe - | ||||
| Cs 0,86 | Ba 0,97 | La* 1,08 | Hf 1,23 | Ta 1,33 | W 1,40 | Re 1,46 | Os 1,52 | Ir 1,55 | Pt 1,44 | ||
| Au 1,42 | Hg 1,44 | Tl 1,44 | Pb 1,55 | Bi 1,67 | Po 1,76 | At 1,90 | Rn - | ||||
| Fr 0,86 | Ra 0,97 | Ac** 1,00 | *Лантаноиды - 1,08 - 1,14 **Актиноиды - 1,11 - 1,20 |
 |
Элементы, стоящие левее, будут оттягивать общие электроны от элементов стоящих правее.
Для наглядного изображения ковалентной связи в химических формулах используются точки ( каждая точка отвечает валентному электрону, а также черта отвечает общей электронной паре ).
Пример. Связи в молекуле Cl2 можно изобразить так:
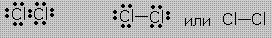
Такие записи формул равнозначны. Ковалентные связи обладают пространственной направленностью. В результате ковалентного связывания атомов образуются либо молекулы, либо атомные кристаллические решётки со строго определенным геометрическим расположением атомов. Каждому веществу соответствует своя структура.
С позиции теории Бора образование ковалентной связи объясняется тенденцией атомов преобразовывать свой внешний слой в октет ( полное заполнение до 8 электронов).Оба атома представляют для образования ковалентной связи по одному неспаренному электрону, и оба электрона становятся общими.
Пример. Образование молекулы хлора.
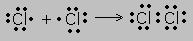
Точками обозначены электроны. При расстановке следует соблюдать правило:электроны ставятся в определённой последовательности-слева, сверху, справа,снизу по одному, затем добавляют по одному, неспаренные электроны и принимают участие в образовании связи.
Новая электронная пара, возникшая из двух неспаренных электронов, становится общей для двух атомов хлора. Существует несколько способов образования ковалентных связей за счёт перекрывания электронных облаков.
| s-s- связь |  |
| s-p- связь |  |
| p-p- связь | 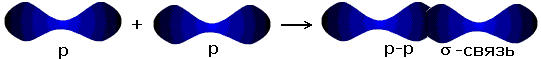 |
| p-p- связь | 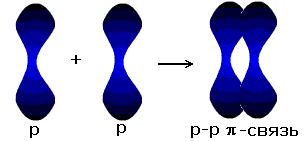 |
σ - связь значительно прочнее π-связи, причём π-связь может быть только с σ-связью, За счёт этой связи образуются двойные и тройные кратные связи.
Полярные ковалентные связи образуются между атомами с разной электроотрицательностью.

За счёт смещения электронов от водорода к хлору атом хлора заряжается частично отрицательно, водорода-частично положительно, т.е. молекула станет диполем.
6.вопрос
Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространства В зависимости от типа химической реакции (гомогенная или гетерогенная) меняется характер реакционного пространства. Реакционным пространством принято называть область, в которой локализован химический процесс: объем (V), площадь (S).
Реакционным пространством гомогенных реакций является объем, заполненный реагентами. Так как отношение количества вещества к единице объема называется концентрацией (с), то скорость гомогенной реакции равна изменению концентрации исходных веществ или продуктов реакции во времени. Различают среднюю и мгновенную скорости реакции.
Средняя скорость реакции равна:
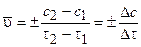 , (3.1)
, (3.1)
где с2 и с1 - концентрации исходных веществ в моменты времени t2 и t1.
Знак минус «-» в этом выражении ставится при нахождении скорости через изменение концентрации реагентов (в этом случае Dс < 0, так как со временем концентрации реагентов уменьшаются); концентрации продуктов со временем нарастают, и в этом случае используется знак плюс «+».
Скорость реакции в данный момент времени или мгновенная (истинная)скорость реакции vравна:
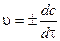 (3.2)
(3.2)
Скорость реакции в СИ имеет единицу [моль×м-3×с-1], также используются и другие единицы величины [моль×л-1×с-1], [моль×см-3 ×с-1], [моль×см –З×мин-1].
Скоростью гетерогенной химической реакции v называют, изменение количества реагирующего вещества (Dn) за единицу времени (Dt) на единице площади раздела фаз (S) и определяется по формуле:
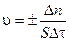 (3.3)
(3.3)
или через производную:
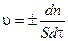 (3.4)
(3.4)
Единица скорости гетерогенной реакции - моль/м2 ×с.
Пример 1. В сосуде смешали хлор и водород. Смесь нагрели. Через 5 с концентрация хлороводорода в сосуде стала равной 0,05 моль/дм3. Определите среднюю скорость образования хлороволорода (моль/дм3 с).
Решение. Определяем изменение концентрации хлороводорода в сосуде через 5 с после начала реакции:
Dс(HCl)=c2-c1,
где с2, с1 - конечная и начальная молярная концентрация HСl.
Dс (НСl) = 0,05 - 0 = 0,05 моль/дм3.
Рассчитаем среднюю скорость образования хлороводорода, используя уравнение (3.1):
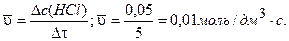
Ответ: 7 = 0,01 моль/дм3 ×с.
Пример 2. В сосуде объемом 3 дм3 протекает реакция:
C2H2 + 2H2®C2H6.
Исходная масса водорода равна 1 г. Через 2 с после начала реакции масса водорода стала равной 0,4 г. Определите среднюю скорость образования С2Н6 (моль/дм'×с).
Решение. Масса водорода, вступившего в реакцию (mпрор (H2)), равна разнице между исходной массой водорода (mисх (Н2)) и конечной массой непрореагировавшего водорода (тк (Н2)):
тпрор.(Н2)= тисх (Н2)-mк(Н2); тпрор (Н2)= 1-0,4 = 0,6 г.
Рассчитаем количество водорода:
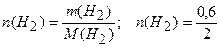 = 0,3 моль.
= 0,3 моль.
Определяем количество образовавшегося С2Н6:
- по уравнению: из 2 моль Н2 образуется ® 1 моль С2Н6;
- по условию: из 0,3 моль Н2 образуется ® х моль С2Н6.
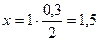 ;
;
 n(С2Н6) = 0,15 моль.
n(С2Н6) = 0,15 моль.
Вычисляем концентрацию образовавшегося С2Н6:
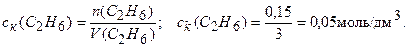
Находим изменение концентрации С2Н6:
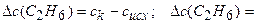 0,05-0 = 0,05 моль/дм3. Рассчитаем среднюю скорость образования С2Н6, используя уравнение (3.1):
0,05-0 = 0,05 моль/дм3. Рассчитаем среднюю скорость образования С2Н6, используя уравнение (3.1):
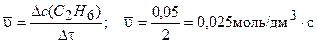 .
.
Ответ: 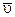 =0,025 моль/дм3 ×с.
=0,025 моль/дм3 ×с.
Факторы, влияющие на скорость химической реакции. Скорость химической реакции определяется следующими основными факторами:
1) природой реагирующих веществ (энергия активации);
2) концентрацией реагирующих веществ (закон действующих масс);
3) температурой (правило Вант-Гоффа);
4) наличием катализаторов (энергия активации);
5) давлением (реакции с участием газов);
6) степенью измельчения (реакции, протекающие с участием твердых веществ);
7) видом излучения (видимое, УФ, ИК, рентгеновское).
Зависимость скорости химической реакции от концентрации выражается основным законом химической кинетики - законом действующих масс.
Закон действующих масс. В 1865 г. профессор Н. Н. Бекетов впервые высказал гипотезу о количественной взаимосвязи между массами реагентов и временем течения реакции: «... притяжение пропорционально произведению действующих масс». Эта гипотеза нашла подтверждение в законе действия масс, который был установлен в 1867 г. двумя норвежскими химиками К. М. Гульдбергом и П. Вааге. Современная формулировка закона действия масс такова: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степе нях, равных стехиометрическим коэффициентам в уравненш реакции.
Для реакции аА + bВ = тМ + nN кинетическое уравнение за-кона действия масс имеет вид:
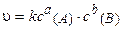 , (3.5)
, (3.5)
где 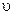 - скорость реакции;
- скорость реакции;
k - коэффициент пропорциональности, называемый константой скорости химической реакции (при 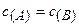 = 1 моль/дм3 k численно равна
= 1 моль/дм3 k численно равна 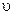 );
); 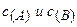 - концентрации реагентов, участвующих в реакции.
- концентрации реагентов, участвующих в реакции.
Константа скорости химической реакции не зависит от концентрации реагентов, а определяется природой реагирующих веществ и условиями протекания реакций (температурой, наличием катализатора). Для конкретной реакции, протекающей при данных условиях, константа скорости есть величина постоянная.
Пример 3. Написать кинетическое уравнение закона действия масс для реакции:
2NO (г) + С12 (г) = 2NOCl (г).
Решение. Уравнение (3.5) для данной химической реакции имеет :ледующий вид:
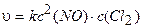 .
.
Для гетерогенных химических реакций в уравнение закона действующих масс входят концентрации только тех веществ, которые находятся в газовой или жидкой фазах. Концентрация вещества, находящегося в твердой фазе, обычно постоянна и входит в константу скорости.
Пример 4. Написать кинетическое уравнение закона действия масс для реакций:
a)4Fe(т) + 3O2(г) = 2Fe2O3(т);
б) СаСОз (т) = СаО (т) + СО2 (г).
Решение. Уравнение (3.5) для данных реакций будет иметь следующий вид:
a) 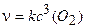 6)
6) 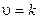
Поскольку карбонат кальция - твердое вещество, концентрация которого не изменяется в ходе реакции, т. е. в данном случае скорость реакции при определенной температуре постоянна.
Пример 5. Во сколько раз увеличится скорость реакции окисления оксида азота (II) кислородом, если концентрации реагентов увеличить в два раза?
Решение. Записываем уравнение реакции:
2NO + О2= 2NO2.
Обозначим начальные и конечные концентрации реагентов соответственно с1(NO), cl(O2) и c2(NO), c2(O2). Точно так же обозначим начальную и конечную скорости реакций: vt, v2. Тогда, используя уравнение (3.5), получим:
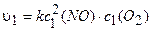 .
.
По условию с2(NO) = 2c1 (NO), с2(О2) =2с1(О2).
Находим v2 =к[2c1(NO)]2 ×2cl(O2).
Находим, во сколько раз увеличится скорость реакции:
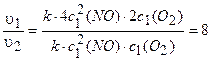
Ответ: в 8 раз.
Влияние давления на скорость химической реакции наиболее существенно для процессов с участием газов. При изменении давления в и раз в п раз уменьшается объем иn раз возрастает концентрация, и наоборот.
Пример 6. Во сколько раз возрастет скорость химической реакции между газообразными веществами, реагирующими по уравнению А + В = С, если увеличить давление в системе в 2 раза?
Решение. Используя уравнение (3.5), выражаем скорость реакции до увеличения давления:
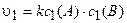 .
.
Кинетическое уравнение после увеличения давления будет иметь следующий вид:
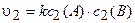 .
.
При увеличении давления в 2 раза объем газовой смеси согласно закону Бойля-Мариотта (рУ = const) уменьшится также в 2 раза. Следовательно, концентрация веществ возрастет в 2 раза.
Таким образом, с2(А) = 2c1(A), c2(B) = 2с1{В). Тогда 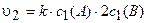
Определяем, во сколько раз возрастет скорость реакции при увеличении давления:
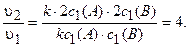
Ответ: в 4 раза.
При решении задач необходимо учитывать, что концентрации реагирующих веществ со временем уменьшаются, а концентрации продуктов растут.
Пример 7. Для реакции 4NH3 + 5О2 = 4NO + 6Н2О начальные концентрации NH3 и О2 равны соответственно 2 моль/дм3 и 3 моль/дм3- Определите их концентрации в момент времени, когда прореагирует 30 % NH3.
Решение. В подобных задачах подразумевается, что объем реакционной системы со временем не изменяется. Пусть объем системы равен 1 дм3, тогда концентрации реагентов, как следует из формулы
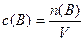 ,
,
численно равны их количествам, т. е. n(NH3) = 2 моль и n(О2) = 3 моль. Далее решаем задачу с использованием количества вещества, а затем определяем концентрации по формуле
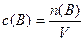 .
.
Рассчитываем количество прореагировавшего аммиака:
nпрор(NH3) = n1(NH3) ×0,3 = 2×0,3 = 0,6 моль. Тогда количество оставшегося аммиака равно:
n2 (NH3 ) = 2 - 0,6 = 1,4 моль,
а его концентрация:
c2(NH3) = 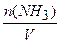 = l,4 моль /дм3.
= l,4 моль /дм3.
Находим количество прореагировавшего кислорода. Согласно уравнению реакции 4 моль NH3 реагирует с 5 моль O2, а 0,6 моль прореагировавшего NH3 будет взаимодействовать с х моль О2.
4 моль МН3 - 5 моль О2;
0,6 моль NH3 - х моль О2.
Отсюда х = 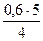 = 0,75 моль.
= 0,75 моль.
Тогда количество оставшегося кислорода равно: n2(O2)=n1(O2)-nпрор (O2)=3-0,75 = 2,25моль;
с2 (О2 )= 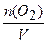 = 2,25 моль/ дм3.
= 2,25 моль/ дм3.
Ответ: 1,4 моль/дм3 NН5; 2,25 моль/дм3 О2.
7.вопрос
КАТАЛИЗ
ТолкованиеПеревод
·
·
·
·
·
·
·
·
КАТАЛИЗ
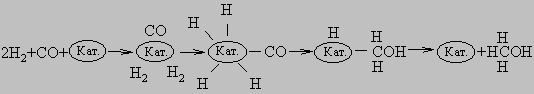
ускорение химических реакций под действием малых количеств веществ (катализаторов), которые сами входе реакции не изменяются. Каталитические процессы играют огромную роль в нашей жизни.Биологические катализаторы, называемые ферментами, участвуют в регуляции биохимических процессов.Без катализаторов не могли бы протекать многие промышленные процессы. Важнейшее свойствокатализаторов - селективность, т.е. способность увеличивать скорость лишь определенных химическихреакций из многих возможных. Это позволяет осуществлять реакции, протекающие в обычных условияхслишком медленно, чтобы им можно было найти практическое применение, и обеспечивает образованиенужных продуктов. Применение катализаторов способствовало бурному развитию химическойпромышленности. Они широко используются при переработке нефти, получении различных продуктов,создании новых материалов (например, пластмасс), нередко более дешевых, чем применявшиеся прежде.Примерно 90% объема современного химического производства основано на каталитических процессах.Особую роль играют каталитические процессы в охране окружающей среды. В 1835 шведский химик Й.Берцелиус установил, что в присутствии определенных веществ скорость некоторых химических реакцийсущественно возрастает. Для таких веществ он ввел термин "катализатор" (от греч. katalysis - расслабление).Как считал Берцелиус, катализаторы обладают особой способностью ослаблять связи между атомами вмолекулах, участвующих в реакции, облегчая таким образом их взаимодействие. Большой вклад в развитиепредставлений о работе катализаторов внес немецкий физикохимик В.Оствальд, который в 1880 далопределение катализатора как вещества, которое изменяет скорость реакции. Согласно современнымпредставлениям, катализатор образует комплекс с реагирующими молекулами, стабилизируемыйхимическими связями. После перегруппировки этот комплекс диссоциирует с высвобождением продуктов икатализатора. Для мономолекулярной реакции превращения молекулы X в Y весь этот процесс можнопредставить в виде X + Кат. -> X-Кат. -> Y-Кат. -> Y + Кат. Высвободившийся катализатор вновь связывается сX, и весь цикл многократно повторяется, обеспечивая образование больших количеств продукта - веществаY. Многие вещества при обычных условиях не вступают в химическую реакцию друг с другом. Так, водород иоксид углерода при комнатной температуре не взаимодействуют между собой, поскольку связь междуатомами в молекуле H2 достаточно прочная и не разрывается при атаке молекулой CO. Катализаторсближает молекулы H2 и CO, образуя с ними связи. После перегруппировки комплекс катализатор - реагентыдиссоциирует с образованием продукта, содержащего атомы C, H и O. Нередко при взаимодействии одних итех же веществ образуются разные продукты. Катализатор может направить процесс по пути, наиболееблагоприятному для образования определенного продукта. Рассмотрим реакцию между CO и H2. Вприсутствии медьсодержащего катализатора практически единственным продуктом реакции являетсяметанол:
 <="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">
<="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">
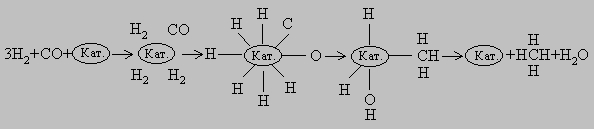
Вначале молекулы СО и Н2 адсорбируются на поверхности катализатора. Затем молекулы СО образуют скатализатором химические связи (происходит хемосорбция), оставаясь в недиссоциированной форме.Молекулы водорода также хемосорбируются на поверхности катализатора, но при этом диссоциируют. Врезультате перегруппировки образуется переходный комплекс Н-Кат.-CH2OH. После присоединения атома Hкомплекс распадается с высвобождением CH3OH и катализатора. В присутствии никелевого катализатора какСО, так и Н2 хемосорбируются на поверхности в диссоциированной форме, и образуется комплекс Кат.-СН3.Конечными продуктами реакции являются СН4 и Н2О:
 <="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">
<="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">
Большинство каталитических реакций проводят при определенных давлении и температуре, пропускаяреакционную смесь, находящуюся в газообразном или жидком состоянии, через реактор, заполненныйчастицами катализатора. Для описания условий проведения реакции и характеристики продуктовиспользуются следующие понятия. Объемная скорость - объем газа или жидкости, проходящий черезединицу объема катализатора в единицу времени. Каталитическая активность - количество реагентов,превращенных катализатором в продукты в единицу времени. Конверсия - доля вещества, превращенного вданной реакции. Селективность - отношение количества определенного продукта к суммарному количествупродуктов (обычно выражается в процентах). Выход - отношение количества данного продукта к количествуисходного материала (обычно выражается в процентах). Производительность - количество продуктовреакции, образующихся в единице объема в единицу времени.
ТИПЫ КАТАЛИЗАТОРОВ
Катализаторы классифицируют исходя из природы реакции, которую они ускоряют, их химического составаили физических свойств. Каталитическими свойствами обладают в той или иной степени практически всехимические элементы и вещества - сами по себе или, чаще, в различных сочетаниях. По своим физическимсвойствам катализаторы делятся на гомогенные и гетерогенные. Гетерогенные катализаторы - это твердыевещества, гомогенные диспергированы в той же газовой или жидкой среде, что и реагирующие вещества.Многие гетерогенные катализаторы содержат металлы. Некоторые металлы, особенно относящиеся к VIIIгруппе периодической системы элементов, обладают каталитической активностью сами по себе; типичныйпример - платина. Но большинство металлов проявляют каталитические свойства, находясь в составесоединений; пример - глинозем (оксид алюминия Al2O3). Необычным свойством многих гетерогенныхкатализаторов является большая площадь их поверхности. Они пронизаны многочисленными порами,суммарная площадь которых иногда достигает 500 м2 на 1 г катализатора. Во многих случаях оксиды сбольшой площадью поверхности служат подложкой, на которой в виде небольших кластеров осаждаютсячастички металлического катализатора. Это обеспечивает эффективное взаимодействие реагентов в газовойили жидкой фазе с каталитически активным металлом. Особый класс гетерогенных катализаторовсоставляют цеолиты - кристаллические минералы группы алюмосиликатов (соединений кремния иалюминия). Хотя многие гетерогенные катализаторы обладают большой площадью поверхности, обычно ониимеют лишь небольшое число активных центров, на долю которых приходится малая часть суммарнойповерхности. Катализаторы могут утрачивать свою активность в присутствии небольших количествхимических соединений, называемых каталитическими ядами. Эти вещества связываются с активнымицентрами, блокируя их. Определение структуры активных центров является предметом интенсивныхисследований. Гомогенные катализаторы имеют различную химическую природу - кислоты (Н2SO4 илиН3РО4), основания (NaOH), органические амины, металлы, чаще всего переходные (Fe или Rh), в формесолей, металлоорганических соединений или карбонилов. К катализаторам относятся также ферменты -белковые молекулы, регулирующие биохимические реакции. Активный центр некоторых ферментовсодержит атом металла (Zn, Cu, Fe или Mo). Металлсодержащие ферменты катализируют реакции сучастием малых молекул (О2, CO2 или N2). Ферменты обладают очень высокой активностью иселективностью, но работают только при определенных условиях, таких, в которых протекают реакции вживых организмах. В промышленности часто используют т.н. иммобилизованные ферменты.
КАК РАБОТАЮТ КАТАЛИЗАТОРЫ
Энергетика. Любая химическая реакция может протекать лишь при условии, что реагенты преодолеютэнергетический барьер, а для этого они должны приобрести определенную энергию. Как мы уже говорили,каталитическая реакция X (r) Y состоит из ряда последовательных стадий. Для протекания каждой из нихнеобходима энергия E, называемая энергией активации. Изменение энергии вдоль координаты реакциипредставлено на рис. 1.
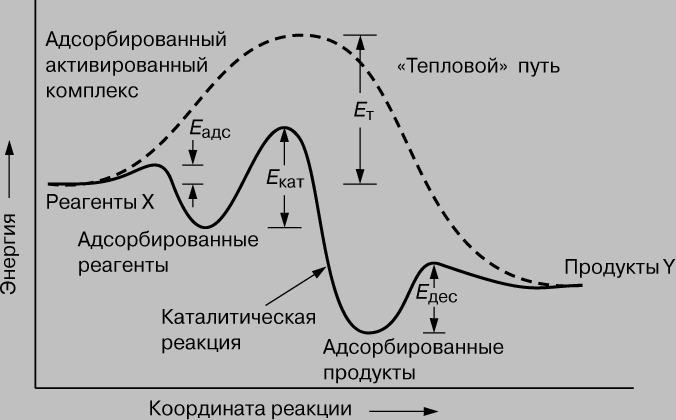
Рис. 1. ИЗМЕНЕНИЕ ЭНЕРГИИ РЕАГЕНТОВ при каталитическом и "тепловом" путях протеканияреакции.
Рассмотрим сначала некаталитический, "тепловой" путь. Чтобы реакция смогла осуществиться,потенциальная энергия молекул X должна превысить энергетический барьер Eт. Каталитическая же реакциясостоит из трех стадий. Первая - образование комплекса Х-Кат. (хемосорбция), энергия активации которойравна Еадс. Вторая стадия - перегруппировка Х-Кат. (r) Y-Кат. с энергией активации Екат, и наконец, третья -десорбция с энергией активации Едес; Еадс, Екат и Едес много меньше Ет. Поскольку скорость реакцииэкспоненциально зависит от энергии активации, каталитическая реакция протекает значительно быстреетепловой при данной температуре. Катализатор можно уподобить инструктору-проводнику, который ведетальпинистов (реагирующие молекулы) через горный хребет. Он проводит одну группу через перевал и затемвозвращается за следующей. Путь через перевал лежит значительно ниже того, который лежит черезвершину (тепловой канал реакции), и группа совершает переход быстрее, чем без проводника(катализатора). Возможно даже, что самостоятельно группа вообще не смогла бы преодолеть хребет.
Теории катализа. Для объяснения механизма каталитических реакций были предложены три группытеорий: геометрические, электронные и химическая. В геометрических теориях основное вниманиеобращено на соответствие между геометрической конфигурацией атомов активных центров катализатора иатомов той части реагирующих молекул, которая ответственна за связывание с катализатором. Электронныетеории исходят из представления, что хемосорбция обусловливается электронным взаимодействием,связанным с переносом заряда, т.е. эти теории связывают каталитическую активность с электроннымисвойствами катализатора. Химическая теория рассматривает катализатор как химическое соединение схарактерными свойствами, которое образует химические связи с реагентами, в результате чего формируетсянестабильный переходный комплекс. После распада комплекса с высвобождением продуктов катализаторвозвращается в исходное состояние. Последняя теория считается сейчас наиболее адекватной. Намолекулярном уровне каталитическую газофазную реакцию можно представить следующим образом. Однареагирующая молекула связывается с активным центром катализатора, а другая взаимодействует с ней,находясь непосредственно в газовой фазе. Возможен и альтернативный механизм: реагирующие молекулыадсорбируются на соседних активных центрах катализатора, а потом взаимодействуют друг с другом. По-видимому, именно таким образом протекает большинство каталитических реакций. Другая концепцияпредполагает, что существует связь между пространственным расположением атомов на поверхностикатализатора и его каталитической активностью. Скорость одних каталитических процессов, в том числемногих реакций гидрирования, не зависит от взаимного расположения каталитически активных атомов наповерхности; скорость других, напротив, существенно изменяется при изменении пространственнойконфигурации поверхностных атомов. В качестве примера можно привести изомеризацию неопентана визопентан и одновременный крекинг последнего до изобутана и метана на поверхности катализатора Pt-Al2O3.
8.вопрос
