Яка з наведених реакцій належить до окисно-відновних?
A.(NH4)2C03→2NH3+C02+H2О B.Mn02+2KOH = K2Mn03+H2O
C.(NH4)2Cr207 →Cr203+N2+4H20 D.Cr(OH)3 +NaOH→NaCr02+2H20
2.Зазначте тип наведеної нижче ОВР 4Fe(OH)2 + 02+ 2Н20 = 4Fe(OH)3.
A.Диспропорціонування B.Міжмолекулярна C.Внутрішньомолекулярна
D.Обміну Е.Заміщення
3.Визначте ступінь окиснення Фосфору в таких сполуках: РН3; КН2Р02; К2НР04; Н3Р03; Са3(Р04)2. Укажіть правильний варіант відповіді, наведений у вигляді суми чисельних значень с. о. з урахуванням знака заряду.А.+13 В.+11 С.+9 D.+5 Е.-З
4.Укажіть сполуку, в якій ступінь окиснення Карбону відрізняється від інших за знаком заряду.A. CF4 В. CO С. С02 D. СН3ОН Е. НСООН
Зазначте схему перетворення, в якій ступінь окиснення Сульфуру не змінюється.
A. S02 → K2S03 →K2S04 В. S →S02 →S03 C. H2S → PbS →PbS04
D.H2S →S →S02 E. S03 →H2S04 → MgS04
У якій з наведених сполук Хром виявляє тільки окисні властивості?
А. Сr203 В. СrО С. К2Сr207 D. КСr02 Е. Сr(ОН)3
Основна та додаткова література:Л. М. Миронович, О. О. Мардашко Медична хімія , Київ, «Каравела», 2008р.ст.4-27, А.С. Мороз, Д.Д. Луцевіч,
Л. П. Яворська Медична хімія, ПП «Нова книга»,2006 р., ст.20-45,
В. П. Музиченко, Д.Д. Луцевіч, Л. П. Яворська Медична хімія, ВСВ «Медицина»,2010 р
Тема 5 : « Біонеоргінчна хімія»
« Способи вираження кількісного складу розчинів (розв’язати задачі)».
1.
Зміст теми:
Склад розчину можна виражати якісно й кількісно. Розчини з відносно низьким вмістом розчиненої речовини називають розведеними, а з відносно високим — концентрованими. Якісна оцінка досить умовна, бо для розчинів різних речовин ці поняття мають свої обмеження. Кількісний склад розчину визначається концентрацією.
Концентрація — це безрозмірна або розмірна величина, яка виражає співвідношення компонентів у системі. Для системи, що складається з розчинника та розчиненої речовини, концентрацією (не розчину, а розчиненої речовини) називають кількість розчиненої речовини, що міститься в певній кількості розчину або розчинника. Найчастіше застосовують такі способи вираження концентрації:
1. Молярна частка — відношення кількості даного компонента до загальної кількості всіх компонентів розчину:
де ni— кількість i-го компонента (у молях).
Аналогічно визначають масову та об'ємну частки.
Масова (об'ємна) частка — відношення маси (об'єму) розчиненої речовини до загальної маси (об'єму) розчину:
де т1 і m2 — маси, а V1 i V2 — об'єми розчиненої речовини та розчинника.
2. Молярність розчину — величина, що чисельно дорівнює молярній концентрації розчиненої речовини. Молярна концентрація — це відношення кількості розчиненої речовини до об'єму розчину V (у літрах):
Розчини однакової молярності (еквімолярні) реагують між собою в об'ємах, пропорційних стехіометричним коефіцієнтам у рівнянні реакції.
4. Моляльність розчину (моляльна концентрація) визначається відношенням кількості розчиненої речовини до маси розчинника (а не розчину!) в кілограмах:
5.
де m2/1000 — маса розчинника в кілограмах. Моляльність розчину, на відміну від його молярності, не залежить від температури.
4. Нормальність розчину — величина, що чисельно дорівнює молярній концентрації еквівалентів. Виражається відношенням еквівалентної кількості розчиненої речовини до об'єму розчину в літрах:
де Ет — молярна маса еквівалента розчиненої речовини.
Розчини однакової нормальності реагують у однакових об'ємах. У разі неоднакових нормальностей розчинів останні взаємодіють в об'ємах, обернено пропорційних їхнім нормальностям:
Нормальність і молярність розчинів збігаються для однокис-лотних основ та одноосновних кислот.
Молярну концентрацію еквівалентів розчиненої речовини можна уявити як відношення молярної концентрації до фактора еквівалентності fе цієї речовини в конкретній реакції Се = См/fе.
5. Титр — відношення маси розчиненої речовини в грамах до об'єму розчину в мілілітрах:
Розчин кожної речовини має певну густину р (г/мл, або кг/л), яку враховують при переході від масових концентрацій до об'ємних, і навпаки.
Матеріали для самоконтролю:
1. Що таке розчини і як їх класифікують?
2. Що таке розчинність і які чинники впливають на неї?
3. Як впливають температура й тиск на розчинність твердих речовин?
4. Що таке молярна концентрація еквівалента? Як її обчислюють?
5.Які властивості належать до колігативних?
Задачі:
Задача № 1.
У воді об’ємом 0,2 л розчинили сіль масою 0,04 кг. Визначити масову частку солі в розчині, якщо густина води дорівнює 1кг/л.
Задача № 2.
Визначити масу розчину з масовою часткою СuSО4 10% і масу води, що необхідні для приготування розчину масою 0,5 кг з масовою часткою СuSО4 2%.
Задача № 3.
Визначити молярну концентрацію розчину з масовою часткою натрій гідроксиду 0,2. Густина розчину – 1,29 кг/л
Правильні відповіді
Задача № 1.
Титр (Т)означає масу розчиненої речовини, що міститься в 1 мл розчину. Масу частіше виражають у грамах (г).
Отже, маємо:
де m (Na+) – маса катіонів Натрію, г,
V (розчину) – об’єм розчину, мл,
ν (Na+) – кількість речовини катіонів Натрію, моль,
М (Na+) – молярна маса катіону Натрію, г/моль.
Задача № 2.
Масова частка (ω) – це відношення маси компоненту (розчиненої речовини) до загальної маси системи (розчину, суміші). Це безрозмірна величина, що виражається частками одиниці, відсотками (частки сотні) тощо.
Мольна частка ( χ ) – це відношення кількості розчиненої речовини (7ν речовини) до загальної кількості розчину (ν розчину). Вона має таку ж розмірність, як і масова частка.
Задача № 3.
Молярна концентрація речовини, що позначається С, – це відношення кількості речовини ν до об’єму розчину V. Молярна концентрація виражається в моль/л.
де ν – кількість речовини СаСl2 , моль,
Vрозчину – об’єм розчину, л.
Якщо Т(СаСl2) = 0,0999 г/мл = 0,0999 кг/л, то в 1 л розчину маємо 0,0999 кг солі.
Молярна концентрація еквівалента речовини, що позначається як Секв , – це відношення кількості речовини еквівалента νекв дo об’єму розчину.
Молярна концентрація еквівалента виражається в моль/л.
де νекв – кількість речовини еквівалента, моль,
V – об’єм розчину, л.
М екв = М . f екв ;
де n – число йонів Н+ у молекулі кислоти,
або гідроксид-іонів ОН- у молекулі основи,
або добуток валентності металу на кількість атомів металу в молекулі солі.
Еквівалент – це така частина речовини (реальна або умовна), що в реакції еквівалентна (відповідає) одному молю атомів Гідрогену (катіонів), або в окисно-відновних реакціях – одному електрону.
Основна та додаткова література:Л. М. Миронович, О. О. Мардашко Медична хімія , Київ, «Каравела», 2008р.ст.4-27, А.С. Мороз, Д.Д. Луцевіч,
Л. П. Яворська Медична хімія, ПП «Нова книга»,2006 р., ст.20-45,
В. П. Музиченко, Д.Д. Луцевіч, Л. П. Яворська Медична хімія, ВСВ «Медицина»,2010 р
Тема 6 : « Біонеоргінчна хімія»
«Сильні і слабкі електроліти (написати рівняння дисоціації)».
Зміст теми:
• Ступінь дисоціації - кількісна характеристика, яку використовують для оцінювання здатності електролітів дисоціювати у водних розчинах на йони. Вивчаючи електролітичну дисоціацію, ми з'ясували, що це оборотний процес. Тобто поряд із розпадом кристалів або молекул на йони може відбуватися асоціація йонів. Адже гідратовані йони, які хаотично рухаються в розчині, можуть стикатися й знов сполучатися між собою. Наразі розгляньмо це питання докладніше. Солі та луги - йонні речовини, тому у водних розчинах вони дисоціюють повністю. У розчинах кислот поряд з йонами є й недисоційовані молекули.
Завдання
Оцініть доцільність доповнення схеми на малюнку 3.2 компонентом «йонно-молекулярні розчини».
Ступінь електролітичної дисоціації - це відношення числа молекул формульних одиниць), які розпалися на йони, до загального числа молекул (формульних одиниць) розчиненої речовини.
Ступінь дисоціації позначають літерою грецького алфавіту а (вимовляємо «альфа»). її виражають у частках одиниці або у відсотках:
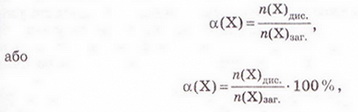
де n(Х) дис. - число формульних одиниць електроліту, які розпалися на йони, а n(Х)заг. - загальне число формульних одиниць електроліту.
Наприклад, якщо ступінь дисоціації фторидної кислоти дорівнює 30 %, або 0,3, це означає, що у водному розчині з кожних ста молекул кислоти тридцять розпалися на йони. Або з кожних десяти молекул кислоти три дисоціювали (мал. 11.1):
а(НF) = 0,3(30 %)

Завдання
1. Виберіть з-поміж наведених значень ступінь дисоціації кислоти, з кожних 100 молекул якої 15 розпалися на йони:
А 0,15; Б 115; В 0,015; Г 1,5.
2. Виберіть співвідношення кількості дисоційованих і недисоційованих молекул кислоти, ступінь дисоціації якої 0,2 (20 %):
А 1 : 5; Б 1 : 50; В 1 : 4; Г 1 : 8.
Ступінь дисоціації електролітів визначають експериментально. Він залежить від природи розчинника, природи розчинюваної речовини та її частки у розчині, температури тощо. Чим більша полярність розчинника, тим більший ступінь дисоціації електроліту в ньому. Підвищення температури, як правило, збільшує дисоціацію, тож за нагрівання ступінь дисоціації зростає. У разі зменшення частки електроліту у розчині, тобто під час його розбавляння, ступінь дисоціації збільшується. Тож, зазначаючи ступінь дисоціації, слід зазначати й концентрацію розчину.
• Сильні й слабкі електроліти різняться здатністю дисоціювати у водних розчинах. Електроліти, ступінь дисоціації яких навіть у відносно концентрованих розчинах високий (близький до 1), називають сильними, а електроліти, ступінь дисоціації яких навіть у розведених розчинах невеликий, - слабкими.
Сильними електролітами є луги та чи не всі солі. У розбавлених розчинах сульфатна, нітратна, хлоридна, бромідна, йодидна кислоти також дисоціюють практично повністю. З класифікацією кислот на сильні и слабкі ви ознайомилися минулого року (див. схему). Тепер вам зрозуміло, що критерієм цієї класифікації є ступінь електролітичної дисоціації кислот, тобто їхня приналежність до сильних чи слабких електролітів.
Пригадаймо, слабка карбонатна кислота міститься у газованих напоях (існує у вигляді гідрату С02 • Н20). Добре відомі вам з повсякденного
життя кислоти - молочна, оцтова, аскорбінова (вітамін С) й ацетил-саліцилова (аспірин) кислоти - слабкі електроліти. Сульфітна, сульфідна, силікатна кислоти (пригадайте їхні хімічні формули, за погреби зверніться до таблиці «Розчинність кислот, основ і солей у воді») також слабкі електроліти. Слабкими електролітами є й гідроксиди металічних елементів (за винятком лугів). Ступінь дисоціації слабких електролітів зазвичай не перевищує 3 %.
Завдання
Роздивіться малюнок 11.2 й розташуйте зображені на ньому електроліти за зростанням їхньої сили.

Вода - дуже слабкий електроліт. Ступінь її дисоціації наближається де 0. Адже з кожного мільярда (1 000 000 000) молекул води на йони розгадаються лише дві. Вочевидь такої кількості йонів замало, аби забезпечити бодай трохи помітну електропровідність дистильованої води.
Стисло про головне
Ступінь дисоціації - кількісна характеристика, яку використовують для оцінювання здатності електролітів дисоціювати у водних розчинах на йони. Солі та луги - йонні речовини, тому у водних розчинах вони дисоціюють повністю. У розчинах кислот поряд з йонами є й недисоційовані молекули.
Ступінь електролітичної дисоціації - це відношення числа молекул (формульних одиниць), які розпалися на йони, до загального числа молекул (формульних одиниць) розчиненої речовини.
Ступінь дисоціації позначають літерою грецького алфавіту а (вимовляють «альфа»). Її виражають у частках одиниці або у відсотках:


де n(X) дис. - кількість формульних одиниць електроліту, які розпалися на йони, а п(Х)заг. - загальна кількість формульних одиниць електроліту.
Ступінь дисоціації електролітів залежить від природи розчинника, природи розчинюваної речовини та її частки у розчині, температури тощо.
Електроліти, ступінь дисоціації яких навіть у відносно концентрованих розчинах високий (близький до 1), називають сильними, а електроліти, ступінь дисоціації яких навіть у розведених розчинах невеликий, - слабкими.
Сильними електролітами є луги та чи не всі солі. У розбавлених розчинах сульфатна, нітратна, хлоридна, бромідна, йодидна кислоти також дисоціюють практично повністю. Силу кислот визначають за ступенем електролітичної дисоціації.
Карбонатна, сульфітна, сульфідна, силікатна, молочна, оцтова, аскорбінова (вітамін С) й ацетилсаліцилова (аспірин) кислоти, гідроксиди металічних елементів (за винятком лугів) - слабкі електроліти. Ступінь дисоціації слабких електролітів зазвичай не перевищує 3 % .
Вода - дуже слабкий електроліт. Ступінь її дисоціації наближається до 0.
Матеріали для самоконтролю:
1. Виберіть правильне твердження. Ступінь електролітичної дисоціації - це відношення:
A Числа молекул, які розпалися на йони, до загального числа молекул розчиненої речовини;
Б Числа молекул, які розпалися на йони, до числа молекул, які не дисоціювали;
В Числа молекул у розчині до числа молекул, які дисоціювали;
Г Числа молекул, які не дисоціювали, до числа молекул, які розпалися на йони.
2. Виберіть з-поміж наведених значень ступінь дисоціації кислоти, з кожних 200 молекул якої 40 розпалися на йони:
А 0,2; Б 20; В 0,02; Г 2.
3. Виберіть співвідношення кількості недисоційованих і дисоційованих молекул кислоти, ступінь дисоціації якої 0,4 (40 %):
A3 : 2; Б2 : 3; В 2 : 5; Г5 : 2.
4. Виберіть слабкі електроліти: А HCl; Б H2S; В Н20; Г H2S04.
5. Виберіть сильну кислоту:
А Бромідна; Б Сульфідна; В Молочна; Г Силікатна.
6. У воді об'ємом 2 л розчинили кислоту кількістю 0,2 моль. Ступінь дисоціації кислоти 0,02. Визначте число її недисоційованих молекул у цьому розчині. Які дані у задачі зайві?
7.Встановіть відповідність між електролітами та ступенем дисоціації.
| Електроліт 1 Сильний 2 Слабкий | Ступінь дисоціації А а = 0 Б а → 1 В 0 < а < 0,03 |
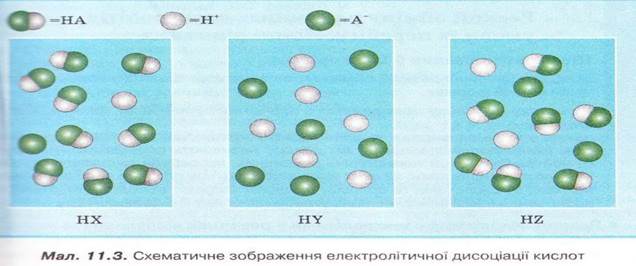
8. Роздивіться малюнок 11.3 і визначте найсильнішу з-поміж зображених на ньому кислот.
Основна та додаткова література:Л. М. Миронович, О. О. Мардашко Медична хімія , Київ, «Каравела», 2008р.ст.4-27, А.С. Мороз, Д.Д. Луцевіч,
Л. П. Яворська Медична хімія, ПП «Нова книга»,2006 р., ст.20-45,
В. П. Музиченко, Д.Д. Луцевіч, Л. П. Яворська Медична хімія, ВСВ «Медицина»,2010 р
Тема 7 : « Біонеоргінчна хімія»
« Гідроліз солей (написати рівняння реакцій)».
Зміст теми: Слово «гідроліз» буквально означає «розкладання водою».
Гідролізом називається усяка взаємодія речовини з водою обмінного характеру, при якій складові частини речовини з'єднуються зі складовими частинами води. Наприклад, складні ефіри розкладаються водою з утворенням суміші кислоти і спирту:

Хлорид фосфору(III) піддається гідролізу, утворити фосфористу і соляну кислоти:

На практиці особливо часто приходиться мати справа з гідролізом солей.
Природно припустити, що розчини середніх солей, що є продуктами повного заміщення протонів у молекулах кислот катіонами металу, повинні мати нейтральну реакцію середовища. Однак це припущення виявляється справедливим тільки у відношенні солей, утворених сильними кислотами і сильними основами.
Солі, утворені слабкою кислотою і сильною чи основою, навпаки, сильною кислотою і слабкою основою, не дають при розчиненні у воді нейтральної реакції середовища. Наприклад, розчин хлориду заліза(III) дає кислу реакцію середовища, що вказує на присутність іонів водню (іонів гідроксонія); розчин карбонату натрію має лужне середовище, обумовлену присутністю в ньому гідроксид-іонів.
Якщо сіль утворена слабкою кислотою і слабкою основою, то реакція розчину залежить від відносної сили, що утворяться в результаті гідролізу кислоти і основи. Наприклад, із двох слабких електролітів, що утворять ціанід амонію, менш слабким електролітом є гідроксид амонію, що підтверджується значеннями констант дисоціації: Кд(NH4OH)=1,79• 10–5; Кд(HCN) = 7,90• 10–10. Виходить, розчин ціаніду амонію буде слаболужним. Розчин ацетату амонію буде нейтральним, тому що константи дисоціації оцтової кислоти і гідроксиду амонію майже однакові: Кд(CH3COOH)=1,86• 10–5; Кд(NH4OH) = 1,79• 10–5.
Ці явища можна пояснити взаємодією іонів розчиненої солі з диполями води, у результаті якого утвориться надлишок водневих іонів (іони гідроксонія) чи гідроксид-іонов.
Оборотна реакція обміну між іонами розчиненої солі й іонами води, що приводить до утворення малодисоційованих часток ( молекули чи іони), зветься гідролізу солі.
Кількісно гідроліз солей може бути охарактеризований ступенем гідролізу і константою гідролізу.
Константа гідролізу і ступінь гідролізу
1. Сіль, утворена слабкою кислотою і сильною основою. Рівняння гідролізу солі ацетату натрію в молекулярній формі:

В іонній формі рівняння має вид:

Застосовуючи до цього оборотного процесу закон діючих мас, запишемо вираження для швидкостей прямої і зворотної реакцій:
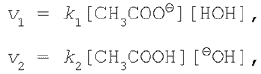
де k1 і k2 – константи швидкості прямої і зворотної реакцій відповідно.
Як і будь-який інший оборотний процес, реакція гідролізу закінчується встановленням хімічної рівноваги, тобто такого стану системи, коли швидкості прямої і зворотної реакцій рівні: v1 = v2.
Відкіля

Константа хімічної рівноваги До дорівнює відношенню константи швидкості прямої реакції до константи швидкості зворотної реакції.
Таким чином,
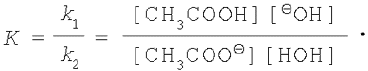
Концентрацію води в розчині допускається вважати величиною постійної, тому об'єднаємо [НОН] і К.

де Кг – константа гідролізу.
Відомо, що

де ДО(H2O) – іонний добуток води.
Підставляючи вираження для  в рівняння константи гідролізу (1), одержимо:
в рівняння константи гідролізу (1), одержимо:
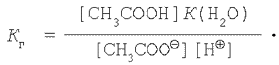
Однак

Тоді остаточно маємо:

Ступенем гідролізу називається відношення кількості гідролізованої солі до загальної кількості розчиненої солі.
Визначимо ступінь гідролізу солі, утвореним слабкою кислотою і сильною основою. Нехай у реакції гідролізу солі ацетату натрію початкова концентрація її, а виходить, і ацетатів-іонів (тому що сіль – сильний електроліт) дорівнює с. Тоді рівноважні концентрації приймуть значення:
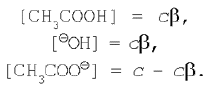
Відобразимо ці вираження в рівняння константи гідролізу (1):

Скориставшись рівнянням (2), одержимо:
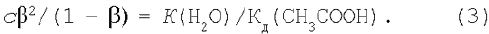

2. Сіль, утворена сильною кислотою і слабкою основою. Рівняння гідролізу солі хлориду амонію в молекулярній формі:

В іонній формі рівняння має вид:

Застосовуючи закон діючих мас, запишемо:

У стані хімічної рівноваги v1=v2, тому
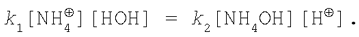
Відкіля
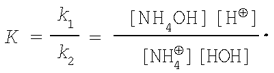
Поєднуючи [НОН] і ДО, одержимо:

Відомо, що 
Підставимо це вираження в рівняння (5) і одержимо:

Знаючи, що

маємо остаточне вираження:

Виведемо рівняння для ступеня гідролізу солі, утвореної слабкою основою і сильною кислотою.
Нехай у реакції гідролізу солі хлориду амонію її початкова концентрація, а виходить, і концентрація катіонів амонію (тому що сіль – сильний електроліт) дорівнює с. Тоді рівноважні концентрації придбають значення:
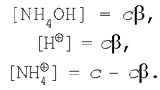
Підставимо ці вираження в рівняння для константи гідролізу (5):

Скориставшись рівнянням (6), одержимо:
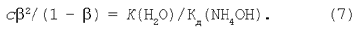
Перетворимо рівняння (7):

3. Сіль, утворена слабкою кислотою і слабкою основою. Рівняння гідролізу солі ціаніду амонію в молекулярній і іонній формах:

Застосуємо закон діючих мас до даного оборотного процесу:
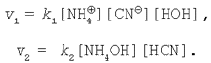
У стані хімічної рівноваги швидкість прямої реакції дорівнює швидкості зворотної реакції:

Константа хімічної рівноваги – це відношення константи швидкості прямої реакції до константи швидкості зворотної реакції:

Як і в попередніх випадках, об'єднаємо K і [НОН]:

Помножимо чисельник і знаменник у рівнянні (9) на величину іонного добутку води:
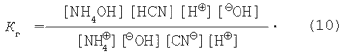
Знаючи, що

перетворимо вираження для константи гідролізу (10).
У результаті одержимо:
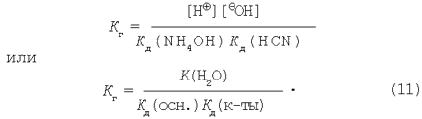
Виразимо ступінь гідролізу солі, утвореним слабкою кислотою і слабкою основою.
Нехай вихідна концентрація солі ціаніду амонію в реакції гідролізу дорівнює с. Вихідні концентрації катіона амонію і ціаніду-аніона також можна вважати рівними з (пам'ятаючи, що сіль – сильний електроліт). Тоді рівноважні концентрації приймуть значення:
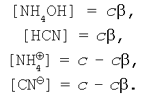
Підставляючи вираження рівноважних концентрацій у рівняння константи гідролізу (9) одержимо:

Дорівнюємо праві частини рівнянь (11) і (12):
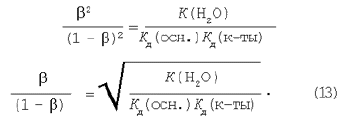
З рівнянь (4), (8), (13) випливає, що ступінь гідролізу тим більше:
чим більше величина ДО(H2O), тобто чим вище температура, тому що іонний добуток води зростає з підвищенням температури;
чим менше константи дисоціації Кд електролітів, що утворять сіль, тобто чим слабкіше електроліти, залишки яких входять до складу солі;
чим менше концентрація солі в розчині, тобто чим більше ступінь розведення розчину (висновок випливає з рівнянь (4) і (8)).
Матеріали для самоконтролю:
1. Яка роль гідролізу в хімічних та біохімічних процесах?
2. Назвіть значненя рН артеріальної та венозної крові.
3. Яка роль гідролізу в хімічних та біохімічних процесах? Зобразіть схематично процес гідролізу АТФ.
Тести:
12.Виберіть сіль, гідроліз якої відбувається за катіоном, тобто за такою схемою:
Кt+ + НОН = КtOН + Н+.
A. Ba(N03)2 В. Na2S04 C. Na2S D. CuCl2 E. К3Р04
13.Напишіть рівняння гідролізу калій нітриту і зазначте молекулярну масу (г/моль) малодисоційованого продукту.А. 33 В. 47 С.38 D.35 Е. 49
