Ізотерма адсорбції Ленгмюра
Адсорбція й абсорбція. Основні поняття
Процес концентрування газів поверхнею твердого тіла називається адсорбцією. Тверде тіло, на поверхні якого відбувається адсорбція, тобто концентрування газу або пари, називається адсорбентом, а речовина, що поглинається з об'ємної фази - адсорбатом. Явище адсорбції газів твердими тілами було відкрите в 1773 р. Шеєле. Це явище дуже розповсюджене та має велике практичне значення.
Процес поглинання адсорбату об'ємом адсорбенту називається абсорбцією. Часто адсорбція й абсорбція спостерігаються одночасно, при цьому сумарний ефект поглинання газу називається сорбцією. У процесі абсорбції при зіткненні двох несумісних фаз проникнення маси однієї фази в глибину іншої у випадку, коли адсорбентом є рідина, є процесом розчинення.
Величина абсорбції залежить від форми твердого тіла. Порошки, що складаються з суцільних пористих часточок, можуть абсорбувати відносно великі кількості речовин.
Фізична та хімічна адсорбція
Розрізняють два види адсорбції: фізичну адсорбцію та хімічну адсорбцію.
Адсорбція зумовлена просто фізичними силами притягування називається фізичною або ван дер ваальсовою адсорбцією і за природою та механізмом він подібний до конденсації пари на поверхні. Якщо поверхня твердого тіла при адсорбції утворює хімічні зв'язки з речовинами іншої фази, то такий процес називається хемосорбцією. Хемосорбція відбувається на поверхні речовин, зокрема тоді, коли адсорбовані молекули іонізуються. Крім цього, хемосорбція проходить на поверхні твердих тіл, а саме на поверхні металів, оксидів, цеолітів, силікагелів і вугілля.
Два види адсорбції - фізичну адсорбцію і хемосорбцію умовно можна розділити за критерієм: сили, що викликають фізичну адсорбцію - це молекулярні сили, які належать до того самого типу, що і сили, які викликають відхилення від законів ідеальних газів і явище конденсації газу в рідину. Вони відомі як сили Ван дер Ваальса. Тому при фізичній адсорбції молекули газу зв'язані з атомами поверхні твердого тіла слабкими ван дер ваальсовими силами (дисперсійними, індукційними й орієнтаційними). Хімічна адсорбція (хемосорбція) зумовлена існуванням хімічних валентних сил між адсорбованими молекулами й атомами поверхні твердого тіла. Газ (реагент або адсорбат) утворює при цьому поверхневі сполуки. Відмінність хімічної адсорбції від фізичної полягає в тому, що в хімічній адсорбції проходять переноси електронів між адсорбентом та адсорбатом, тоді як при фізичній адсорбції такого переносу не відбувається. При хемосорбції на відміну від фізичної адсорбції, утворюються міцні хімічні зв'язки - іонні, ковалентні, координаційні (іон-дипольна взаємодія) -тому вона більш специфічна, ніж фізична адсорбція.
Ізотерма адсорбції Ленгмюра
Ізотерма адсорбції Ленгмюра ґрунтується на моделі ідеально локалізованого адсорбованого моношару, визначення якого було сформульовано Фаулером: "...необхідна й достатня умова, щоб атоми (або молекули) газу адсорбувались на певних центрах на поверхні адсорбенту полягає в тому, що кожний центр може прийняти один і лише один адсорбований атом, а енергія стану будь-якого адсорбованого атому не залежить від присутності інших адсорбованих атомів на сусідніх центрах".
В основу теорії Ленгмюра покладено такі основні положення - постулати.
1) По-перше, що поверхня твердого тіла має обмежене число незалежних адсорбційних місць. Незалежність місць означає, що адсорбція на одному місці не змінює умови адсорбції на другому. На кожному місці може адсорбуватися одна молекула газу - на один активний центр поверхні при-ходиться одна частинка (немає дисоціації й асоціації при адсорбції). Такі місця можуть існувати і при хімічній, і при фізичній адсорбції. У першому випадку - це окремі ненаси-чені валентності поверхневих атомів адсорбента, у другому - це площадки на поверхні.
2) Друге положення - всі адсорбційні центри на поверхні твердого тіла, на яких відбувається адсорбція, мають однакову спорідненість до молекул газу - адсорбату, тобто всі місця енергетично рівноцінні і вважається, що поверхня однорідна.
3) Між адсорбованими частинками відсутня взаємодія, тобто присутність молекул на одній ділянці не впливає на властивості молекул сусідніх ділянок.
4) Газ - адсорбат поводить себе як ідеальний газ;
5) Адсорбція обмежується мономолекулярним шаром;
6) Адсорбовані молекули газу локалізовані, тобто не пересуваються по поверхні.
Рівняння Ленгмюра можна одержати, якщо розглядати рівновагу при адсорбції, яку можна зобразити так:
Адсорбат у Вільний активний Адсорбат в
газовій фазі + центр поверхні = поверхневому шарі
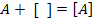
Урахуємо ступінь заповнення поверхні адсорбатом (θ):
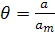 (1)
(1)
де a - кількість адсорбату в поверхневому шарі, am - максимальна кількість адсорбованої речовини при ступені заповнення θ =1, тобто це кількість адсорбату, що потрібна для покриття всього адсорбенту моношаром.
Згідно з теорією Ленгмюра, для константи адсорбційної рівноваги (К) маємо:
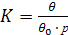 (2)
(2)
де р - тиск адсорбату в газовій фазі. Оскільки сума зайнятих і вільних місць дорівнює загальному числу місць, здатних до адсорбції, то
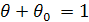 (3)
(3)
Тоді
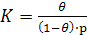 (4)
(4)
Розв'язок рівняння (4) відносно θ, дає:
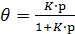 (5)
(5)
З урахуванням виразу (1), рівняння (5) має вигляд:
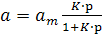 (6)
(6)
Одержаний вираз (6) є рівнянням ізотерми адсорбції Ленгмюра.
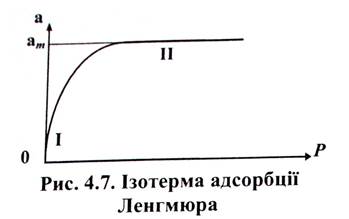
Це рівняння локалізованої мономолекулярної адсорбції на однорідній поверхні. Залежність величини адсорбції від тиску газу, що описується рівнянням ізотерми адсорбції Ленгмюра, наведена на рис. 4.7. Кількість адсорбату при справедливості моделі ідеального адсорбованого шару пропорційна частці поверхні адсорбенту 0, що зайнята адсорбованою речовиною.
Аналіз рівняння (6) показує, що при незначній адсорбції ( ступінь заповнення поверхні θ малий), або при низькому тиску пари адсорбату ( при малих тисках р 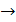 0) можна вважати, що Кр
0) можна вважати, що Кр 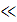 1, тому 1 + Кр
1, тому 1 + Кр 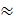 1 і ізотерма Ленгмюра набуває такого вигляду:
1 і ізотерма Ленгмюра набуває такого вигляду:
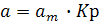 або
або 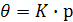 (7)
(7)
Коли концентрація адсорбату мала (р 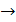 0) і існує багато вільних ділянок на поверхні, то ступінь заповнення поверхні малий і пропорційний тиску речовини в об'ємі газу. Тобто, між адсорбцією і тиском існує лінійний зв'язок. Ця область тисків -ділянка І на рис. 4.7 - називається "областю Генрі", відповідно до рівняння (7) - "закону або ізотермою Генрі". Таким чином, в області малих концентрацій рівняння Ленгмюра переходить у рівняння Генрі.
0) і існує багато вільних ділянок на поверхні, то ступінь заповнення поверхні малий і пропорційний тиску речовини в об'ємі газу. Тобто, між адсорбцією і тиском існує лінійний зв'язок. Ця область тисків -ділянка І на рис. 4.7 - називається "областю Генрі", відповідно до рівняння (7) - "закону або ізотермою Генрі". Таким чином, в області малих концентрацій рівняння Ленгмюра переходить у рівняння Генрі.
При значній адсорбції або при високому тиску (К або тиск великий p 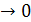 ), Кр
), Кр 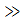 1, тому 1 + Кр
1, тому 1 + Кр 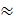 Кр і тоді а = ат, або θ = 1. Це означає, що всі активні центри на поверхні твердого тіла повністю заповнені адсорбованою речовиною і подальше збільшення парціального тиску речовини в газовій суміші не впливає на її кількість, що адсорбована на поверхні твердого тіла. Тобто відбувається насичення адсорбенту і подальша адсорбція припиняється. На рис. 4.7 ізотерми адсорбції Ленгмюра це ділянка II, що відповідає області насичення; при цьому крива асимптотично наближається допрямоїі а = ат або θ = 1.
Кр і тоді а = ат, або θ = 1. Це означає, що всі активні центри на поверхні твердого тіла повністю заповнені адсорбованою речовиною і подальше збільшення парціального тиску речовини в газовій суміші не впливає на її кількість, що адсорбована на поверхні твердого тіла. Тобто відбувається насичення адсорбенту і подальша адсорбція припиняється. На рис. 4.7 ізотерми адсорбції Ленгмюра це ділянка II, що відповідає області насичення; при цьому крива асимптотично наближається допрямоїі а = ат або θ = 1.
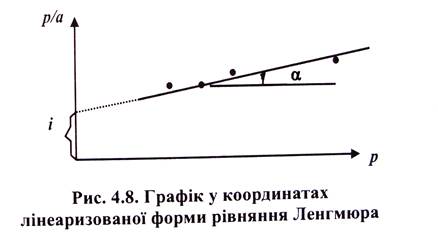
Таким чином, із рівняння Ленгмюра випливає, що спочатку адсорбція зростає пропорційно збільшенню концентрації, потім збільшення уповільнюється, і, нарешті, коли настає межа насичення, адсорбція припиняється. Ізотерма адсорбції Ленгмюра графічно має вигляд гіперболи, що розташована випуклою частиною від осі концентрацій та асимптотично наближається до межі, яка відповідає ат. Величина аm - це кількість адсорбованої речовини (у молях на грам адсорбенту), що покриває поверхню адсорбента щільним моношаром. Цю величину називають ємністю мономолекулярного шару. Ізотерма Ленгмюра описується двома параметрами (ат та К) і ці величини можна знайти графічно з лінєаризованої форми рівняння Ленгмюра:
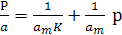 (8)
(8)
Залежність р/а = f(р) є лінійною при справедливості припущення про енергетичну рівноцінність всіх ділянок поверхні. Із графіка р/а = f(р) (рис. 4.8) можна знайти два параметри рівняння Ленгмюра (ат та К). Тангенс кута нахилу цієї прямої дорівнює:
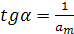 , звідки
, звідки 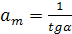 (9)
(9)
Відрізок, що відтинається прямою на осі ординат згідно рівнянням (8) дорівнює: 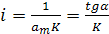 , звідки константа адсорбційної рівноваги дорівнює:
, звідки константа адсорбційної рівноваги дорівнює:
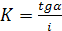 (10)
(10)
Очевидно, що ємність мономолекулярного шару (ат) не повинна залежати від температури. Знаючи ємність мономолекулярного шару, можна визначити питому поверхню адсорбенту Sпит, якщо відома площа ω, яку займає одна адсорбована молекула:
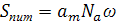
де ат - виражається в моль/г; ω - "посадковий майданчик" - місце, що займає одна молекула адсорбату в мономолекулярному поверхневому шарі (м2), значення ω можна розрахувати з ван дер вааль-сових розмірів молекул, їхньої орієнтації біля поверхні й упаковки, Na - число Авогадо. Sпит виражається в м2/г. Адсорбенти з дуже розвиненою поверхнею - активоване вугілля (500-1000 м2/г), алюмогель, силікагель (200-300 м2/г) тощо.
